Immunologie
Partie 2, Chapitre 3 :
La cytotoxicité cellulaire directe.
Introduction.
On distingue généralement deux réponses immunitaires : cellulaire et humorale.
La réponse immunitaire à médiation cellulaire est caractérisée par l’intervention de cellules développant une cytotoxicité directe (c’est-à-dire qu’elles vont détruire des cellules cibles qui expriment un antigène (du non soi) et avec qui elles ont établi un contact membranaire.
Généralement, les cellules cibles sont du même organisme que les cellules cytotoxiques (c’est le cas des cellules qui hébergent un organisme à développement intracellulaire)
Télécharger le document sur le serveur FTP ou sur le serveur web (HTTP).
L’alloréactivité (situation artificielle).
Cette réaction est due au CMH où les cellules interviennent pour la réponse adaptative et pour la réponse innée.
Pour la réponse adaptative, on retrouvera deux grands types de cellules : des lymphocytes cytotoxiques qui donneront presque tous des lymphocytes T CD8. Il y a reconnaissance spécifique d’épitopes sur la cellule cible via le TCR (CMH de classe 1).
L’autre type cellulaire est représenté par les cellules K. Ce sont des cellules non T mais qui développent une activité cytolytique anticorps dépendante (ADCC). Cela implique des anticorps fixés sur une cellule cible et donc, la présence de récepteurs au fragment Fc des Ig (le récepteur RFc). L’action de ces cellules a lieu après la réaction humorale.
Dans le cas de la réponse immunitaire innée, celle-ci est réalisée par les cellules NK (natural killer).
Remarque : les macrophages activés peuvent faire preuve de cytotoxicité.
I La cytotoxicité cellulaire T : Les lymphocytes T CD8+.
L’activité principale de ces cellules est la lutte antivirale. Leur action est consécutive à la reconnaissance spécifique d’une molécule virale dans le CMH de classe 1.
Reconnaissance : sélection des lymphocytes T, puis expansion clonale qui donnera un pool de cellules filles dont une partie va accomplir une différenciation fonctionnelle en lymphocytes cytolytiques (CTL) qui sont les cellules effectrices dans la destruction des cellules cibles. L’autre partie du pool donnera des lymphocytes T cytotoxiques mémoire.
A L’activation (passage de Tc à TCL).
Cette activation requière deux types de signaux.
Le premier signal est généré par une reconnaissance spécifique de l’épitope (interaction CMH1 + peptide –> TCR + CD8). IL y a alors un signal intracellulaire activant l’expression membranaire du récepteur (membranaire) à haute affinité pour l’IL2. Au repos, le récepteur à IL2 est de faible affinité.
Après reconnaissance, il y a synthèse de la sous-unité a, qui permet la forte affinité pour IL2.
Le deuxième signal va être la libération d’IL2, qui est nécessaire à l’expansion clonale de ce lymphocyte recruté par l’antigène.
Cas d’un lymphocyte naïf.
La production d’IL2 va dépendre de l’activation des T auxiliaires (d’une sous population de T auxiliaires de type 1). Ils produisent majoritairement de l’IL2 et de l’INF.
Dans le cas de réaction humorale, les T auxiliaires se différencient en type 2 et libèreront IL4, IL5, IL6 et IL10. IL4 réprime la différenciation en T auxiliaire de type1.
La différenciation de ces T auxiliaires est contrôlée par le type de leucocytes prédominants (réaction immédiate).
Cas des lymphocytes mémoire.
L’activation et la différenciation en lymphocytes T cytolytiques sont indépendantes de l’activation des lymphocytes T auxiliaires.
Les cellules dendritiques, activées par la présence d’un antigène, vont générer le deuxième signal co-activateur des lymphocytes cytotoxiques mémoire (correspond à la libération d’IL2).
Les cellules de Langerhans (CPAg professionnelles) ayant captées l’antigène, vont migrer via le système lymphatique jusqu’aux ganglions. A ce niveau, ces cellules caractérisées par une forte expression membranaire de CMH1, vont développer une puissante activité co-stimulatrice des Lymphocytes T cytotoxiques.
Cette activité co-stimulatrice est conditionnée par l’expression d’une molécule de la superfamille des Ig (CD80 ou B71-2) qui interagit avec une molécule membranaire exprimée par les lymphocytes T mémoire (CD28). Cette interaction délivre un signal d’activation du lymphocyte cytotoxique et qui aboutit à l’expression et la libération d’IL2. Cette IL2 va avoir un effet autocrine stimulateur sur les lymphocytes T cytotoxiques avec récepteur à IL.
IL2 a un effet mitogène et permet ainsi l’expansion clonale.
Dans une deuxième étape, les cellules filles issues de cette expansion clonale vont pour une partie se différencier et maturer en lymphocytes cytotoxiques. L’adhérence de ces lymphocytes activés à la cellule cible déclenche une cascade d’évènements qui aboutissent rapidement à la lyse de la cellule cible.
B Phase effectrice de la cytolyse.
Deux mécanismes rendent compte de cette cytolyse.
1 La libération de molécules cytolytiques.
La libération de ces molécules est responsable de la nécrose de la cellule cible.
Cette libération est consécutive à une exocytose Ca2+ dépendante de nombreux granules cytoplasmiques. Dans les secondes qui suivent l’adhésion du CTL à la cellule cible, on aura une brutale augmentation du taux de calcium dans le CTL qui est responsable d’une relocalisation des structures golgiennes et des granules cytoplasmiques. Ces granules vont migrer et s’accumuler au pôle qui est au contact de la cellule cible.
Cette relocalisation du golgi et des granules intervient dans la préservation des cellules environnantes.
Les granules vont libérer des molécules cytolytiques dont la perforine. Cette protéine de 600000Da présente de fortes homologies structurales avec le C9 du complément. Au contact de la cellule cible, ces molécules s’insèrent dans la bicouche lipidique et se polymérisent grâce au calcium. On obtient des trous homologues au polyC9.
Il y a alors nécrose de la cellule.
2 L’induction de l’apoptose.
L’induction de l’apoptose se fait selon deux voies.
a Libération de sérine-protéase (ou granzyme).
Ici, il s’agit de protéases contenues dans les granules du CTL, sous forme de complexes inactifs associant des protéoglycanes.
Le granzyme va pénétrer dans les cellules cibles via les canaux de perforine. Ces protéases vont être reponsables d’une fragmentation de l’ADN en oligomères d’environ 200 paires de bases.
Ces sérines protéases activent dans les cellules cibles, la voie endogène de l’apoptose (voie des caspases), à l’issue de laquelle des nucléases seront activées et dégraderont l’ADN cellulaire et l’ADN virale.
Ainsi, il n’y a pas de particules virales libérées.
b Interaction de molécules membranaires : Fas/Fas-Ligand.
Le Fas est un récepteur de la cellule cible, apparenté au récepteur du TNF qui interagit avec une molécule membranaire du CTL : le Fas-ligand. Cette molécule de 30KDa est proche du TNF.
Cette voie joue un rôle mineur dans l’activité cytolytique des CTL.
c La libération de cytokines.
Le CTL libère du TNFa qui induit l’apoptose.
L’INF a a une activité antivirale et antitumorale.
II Cytotoxicité cellulaire naturelle : cellules NK.
A Caractères cytologiques de ces cellules NK.
Les NK ont été initialement identifiées par leur capacité à détruire in vitro, certaines lignées de cellules tumorales, en dehors d’une sensibilisation tumorale. Les cellules NK sont présentes chez les individus sains (sans tumeurs).
Leur cytotoxicité est non spécifique.
Les NK sont de grands lymphocytes, granuleux, représentant jusqu’à 10% des lymphocytes circulant dans le sang.
Ces cellules naissent et se différencient dans la moelle osseuse. Ils n’ont pas de TCR ni de complexe CD3. Ils sont dits : TCR-, CD3-.
Chez les souris « nude » et chez les souris « dix », les cellules NK sont là et sont bien fonctionnelles. Elles n’ont pas besoin de réarrangement génétique.
CD56 : c’est une glycoprotéine membranaire appartenant à une famille d’adhérence proche des N-CAM. Leur fonction est inconnue.
CD16 : c’est récepteur de faible affinité au fragment Fc des IgG (CD16 = FcγRIII).
Récepteurs aux molécules du CMH1. Ils sont en fait des inhibiteurs de l’activation des cellules NK. (KIR).
Récepteurs activateurs des NK (les KAR).
Outre ces molécules, la cellule NK exprime de nombreuses molécules d’adhérence cellulaire (ß2 intégrine LFA1, CD2 qui interagit avec la LFA3).
B Caractéristiques fonctionnelles.
Les cellules NK sont le support de la réponse immunitaire innée à l’égard d’antigènes à localisation intracellulaire : participent donc aux réponses antivirales, antitumorales immédiates.
L’action des NK n’a pas besoin de sensibilisation.
Le nombre de cellules NK rapidement disponibles est très élevé.
Ces cellules forment la première ligne de défense interne qui permet d’endiguer une infection virale, dans l’attente de l’intervention des mécanismes adaptatifs (lymphocytes T cytotoxiques).
L’activité NK est stimulée par la libération de cytokines inflammatoires (INFα et ß ; IL2). Ces cytokines sont produites dès le début d’une infection virale. On pourra observer un pic de NK qui suit le pic de libération des interleukines considérées (inflammatoires).
C Mécanismes de la cytolyse.
Les NK activées tuent les cellules cibles selon les mêmes mécanismes que les CTL. D’s l’adhérence à la cellule cible, il y a libération de granules (perforine et granzyme) qui rendent compte de l’apoptose de la cellule et de la nécrose cellulaire.
L’apoptose se produit très rapidement, avant la nécrose, afin de limiter la quantité de molécules infectieuses.
La cellule NK, comme le CTL, produit des cytokines dont le TNFα (augmentation de l’apoptose) et l’INFγ qui participent à la défense antivirale selon plusieurs mécanismes :
- Effet positif très fort autocrine sur les NK ;
- Effet positif très fort paracrine, sur les cellules phagocytaires comme les macrophages ;
- Il y a augmentation sur les cellules cibles à INFγ, de la transcription des gènes du CMH1 et du CMH2. Cela accroît l’expression membranaire de ces molécules. Il y a augmentation de l’activité des CTL (et des T auxiliaires) ;
- Augmentation de l’expression membranaire des récepteurs au fragment Fc des IgG sur les macrophages (stimule la cytotoxicité cellulaire dépendante des anticorps).
D Mécanismes d’activation des cellules NK.
Plusieurs observations font état d’une activation des NK à la suite d’un effet d’expression membranaire du CMH1 par les cellules cibles.
Dans le cas des cellules cibles hébergeant des virus comme l’adénovirus, ou le cytomégalovirus, il va y avoir piégeage des molécules de CMH dans le cytoplasme de la cellule infectée, ce qui empêche la présentation des peptides viraux. C’est une stratégie d’échappement au système de défense.
De nombreuses lignées de cellules tumorales ont ce problème de CMH. Si l’on transfecte ces lignées tumorales, sensibles à NK, avec le CMH1, on va leur conférer une résistance aux cellules NK.
L’ensemble de ces observations, confortées par des expériences de transgenèse, suggère que les récepteurs membranaires des molécules de CMH exprimés par les NK, empêchent leur activation.
Quand les NK reconnaissent du soi, elles sont inhibées.
On trouvera deux types structuraux de récepteurs au CMH1.
1 Récepteurs de la famille des lectines (végétales à C-lectines).
Chez la souris, on observe la famille des Ly49. Ce sont des molécules codées par un système multigénique (environ 10 gènes apparentés) localisés sur une paire chromosomique : le complexe NKC.
Chez l’Homme, ce sont les molécules de la famille CD94/NKG2 qui nous intéressent.
Ce sont des molécules hétérodimériques associant une chaîne polypeptidique invariante (le CD49) à une chaîne variante (NKG2). Les gènes codant pour ces chaînes sont également localisés sur une paire chromosomique (le NKC humain).
2 Récepteurs de la superfamille des Ig (chez l’Homme).
Ce sont ces récepteurs qui ont initialement été qualifiés de KIR.
On a tout un ensemble de molécules à variabilité se structure, à la fois dans la partie extracellulaire (domaines Ig) et dans la partie intracytoplasmique. Cette dernière partie sera plus ou moins longue et les récepteurs sont classés sous l’appellation :
- KIR2DL (L pour long),
- KIR3DL (3D pour trois domaines extracellulaires),
- KIR2DS.
Les KIR sont sous contrôle d’environ 12 gènes et aussi d’un système polyallélique : il en résulte un large répertoire de reconnaissance des molécules de CMH1. Chaque récepteur reconnaît plusieurs allèles d’un même locus.
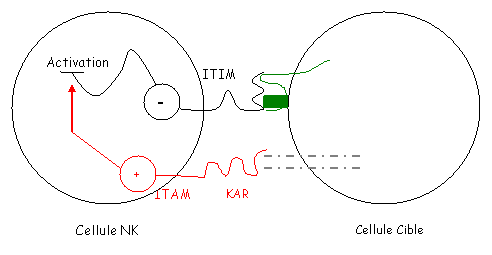
L’interaction de ces récepteurs avec les molécules de CMH1 verrouille l’activité des NK. Ceci est lié à une séquence ITIM portée par des régions cytoplasmiques à motifs tyrosine qui vont inhiber les NK par recrutement d’une phosphatase qui désactive plusieurs transducteurs (qui activent normalement les NK).
Le verrou est levé quand il n’y a pas de CMH1 sur la surface cellulaire. Les NK deviennent alors activables. C’est à ce moment là qu’interviennent les KAR. Ces KAR appartiennent à la superfamille de Ig mais diffèrent des KIR par leur région intracytoplasmique qui possède un motif ITAM. Ce motif va activer les transducteurs de la voie d’activation.
Au niveau des cellules cibles, la nature du ligand des KAR est inconnue.
IIICytotoxicité cellulaire dépendante des anticorps (ADCC) : les cellules K.
Quand une cellule est la cible des anticorps, après développement de la réaction humorale, cette cellule peut être lysée, suite à l’activation, soit du complément, soit par intervention d’effecteurs cellulaires : les cellules K. Ces cellules K forment un ensemble de cellules caractérisées par une cellule avec récepteur membranaire au Fc des Ig.
La molécule d’Ig joue le rôle d’adaptateur enter la cellule cible et la cellule K.
Les récepteurs Fc forment une famille complexe de molécules appartenant majoritairement à la superfamille des Ig : deux à trois domaines extracellulaires de type Ig ainsi qu’une région membranaire et une région cytoplasmique.
On distingue deux grands types de récepteurs :
- Les récepteurs à forte affinité (R1Fc) : ils lient les Ig avec des constantes d’association élevées (109 à 1010M-1). Ces récepteurs ont une expression restreinte.
- >Les récepteurs de moyenne ou faible affinité : R2,3Fc. Ils ont une constante d’association inférieure à 107M-1. Ils sont exprimés dans de nombreux types cellulaires. Ils vont interagir avec les Ig sous forme complexée avec un antigène ou entre Ig.
- Les récepteurs au Fc des IgG : FcγR. Ce sont des récepteurs à haute affinité. On trouve FcγR1 (CD64), exprimé sur les monocytes et macrophages; FcγR2 (CD32) exprimés sur monocytes, macrophages, mais aussi sur les polynucléaires, éosinophiles, plaquettes et lymphocytes B; FcγR3 (CD16) sont exprimés sur les memes cellules mais également sur les cellules NK.
- Les récepteurs au Fc des IgE : FcεR. FcεR1 est fortement exprimé sur les mastocytes et les basophiles, ont une haute affinité (10-10). Leur structure est multicaténaire. FcεeR2 (CD23) est un récepteur à moyenne activité. On le retrouve sur les macrophages activés, les plaquettes, les polynucléaires éosinophiles. L’expression de CD23 augmente avec l’IL4.
A Les fonctions des récepteurs aux IgG (Fc).
Ces récepteurs sont des médiateurs de l’activité opsonisante de cette classe d’Ig. Il y a renforcement de l’adhérence des cellules phagocytaires à l’antigène.
L’interaction avec les IgG transduit un signal intracellulaire de l’activation des cellules phagocytaires : production de composés oxygénés et de molécules bactéricides (lysosomes).
Les CD16 ont un rôle pour les NK : renforcent leur activité.
B Les fonctions des récepteurs aux IgE.
FcεR1 va activer ses cellules spécifiques (mastocytes, basophiles) pour déclencher la réponse inflammatoire. Quand il y a une trop forte activation, liée à la synthèse anormale d’IgE, on observe l’hypersensibilité immédiate (= allergie).
FcεR2 (CD23) voit son expression sur les éosinophiles qui rend compte d’une activité cytolytique à l’égard de plusieurs parasites dont les vers intestinaux. Les éosinophiles vont adhérer au parasite et permettre de le recouvrir d’IgG et d’IgE. Cette interaction provoque leur dégranulation avec libération de granules cytolytiques avec perforine, basic major protein (BMP, très active) et CP (cationine protein).
Aucun commentaire jusqu'à présent.