BGU 09, Physiologie Animale :
Chapitre 1 : La Circulation.
Télécharger le document sur le serveur FTP ou sur le serveur web (HTTP).
I Introduction et Rappels.
A Le rôle de la circulation sanguine.
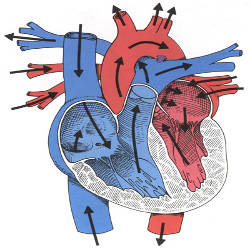
La circulation permet entre autre le transport de l’oxygène qui est devenu nécessaire suite à l’accroissement de taille des organismes. La diffusion ne se fait que pour des surfaces de quelques microns d’épaisseur.
Le sang transporte :
- Les nutriments (produits de la digestion).
- L’oxygène.
- Les déchets (du métabolisme, comme le CO2).
- Les hormones (molécules servant de signaux).
- Des cellules (les globules rouges et cellules du système immunitaire).
- Les anticorps.
- La chaleur pour les animaux endothermes (transport de calories).
B Les compartiments liquidiens d’un organisme.
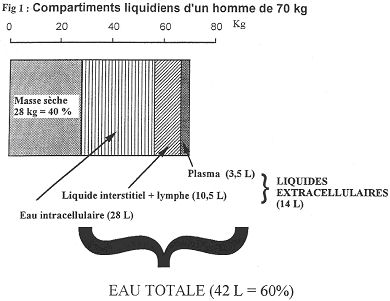
1 Définition des compartiments liquidiens.
On distingue l’eau dans le compartiment intracellulaire et l’eau du compartiment extracellulaire (la moitié).
Le liquide interstitiel, qui baigne les cellules, est composé de 10,5 litres. Il joue un rôle dans l’homéostasie.
Le plasma sanguin ne comprend que 3,5 litres.
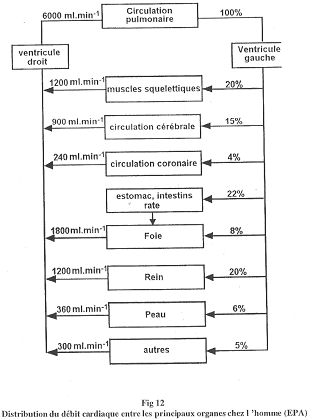
La circulation sanguine ne représente qu’une faible proportion des liquides corporels. Pour être efficace, elle a une vitesse importante. Le débit cardiaque est de 5 litres par minute.
2 Méthode de détermination.
Pour effectuer le calcul d’un volume, on dilue une substance dans le nouveau volume. Il faut tout de même trouver une substance qui reste dans le compartiment étudié.
- Pour l’eau totale, on utilise de l’eau. Cette eau est marquée au tritium (3H2O). Cette eau va se diluer et on regardera le facteur de dilution.
- Pour le plasma, on utilise l’albumine. Cette dernière ne quitte pas la circulation sanguine (en réalité, elle ne quitte que très peu ce compartiment). L’albumine utilisée sera marquée radioactivement par de l’iode (radioactif). On peut aussi utiliser le bleu Hevans (ou T18-24) à la place de l’albumine.
Au début de l’expérience, on observe l’effet de dilution, puis une phase de plateau (ceci est valable pour toutes les molécules).
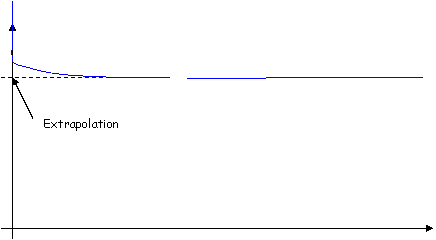
- Pour l’eau extracellulaire, on utilise du Bromure (Brome).
- Pour le volume interstitiel on fait la différence entre « l’espace brome » (eau extracellulaire) et le volume plasmatique (« espace albumine »).
- Pour l’eau cellulaire, on fait la différence entre l’eau totale et l’eau extracellulaire (espace brome).
Il y a toujours des mouvements d’eau d’une espace à un autre.
La circulation est en relation avec l’eau extracellulaire. Chez les mammifères, l’appareil circulatoire est clos mais pas étanche. Les échanges se font du plasma vers le milieu extracellulaire (grâce à la pression osmotique) : c’est la filtration capillaire.
La pression sanguine fait passer le liquide vers le milieu extracellulaire (sens hydrostatique). La pression oncotique fait entrer le liquide (vers le sang).
| Plasma | Liquide extracellulaire et interstitiel | Liquide intracellulaire | |
|---|---|---|---|
| Cations | Na+ | Na+ | K+ |
| Lipides | Peu de différence | ||
| Protéines | +++ | + | ++++++ |
| Phosphates | Très peu | ++++ |
La barrière épithéliale bloque les grosses molécules mais laisse passer les petites.
C Les méthodes d’étude de l’appareil cardiovasculaire.
1 Les variables mesurables.
On peut mesurer :
- Des pressions : la pression artérielle (en mm de Hg). Une pression n’est pas une force.
- Des débits : par exemple, le débit cardiaque (5 litres par minute chez l’Homme).
- Des volumes : par exemple, le volume du ventricule (120mL en moyenne chez l’Homme).
2 Mesures de Pressions.
a Les méthodes indirectes.
- La méthode auscultatoire : pour cette méthode, on a besoin d’un brassard et d’un stéthoscope. On va mesurer la pression artérielle diastolique et systolique (pressions moyennes)
- Par Finapres : dans ce cas, on va mesurer la pression artérielle en continue. On place un « brassard » sur le doigt. L’intérêt de cette méthode est qu’elle donne la pression à chaque battement cardiaque (on voit alors les différences de pression).
b Les mesures directes (méthodes sanglantes).
Pour les méthodes sanglantes, on a deux voies d’entrée :
- La voie veineuse par cathétérisme droit (jambe ou bras). Dans ce cas, on peut atteindre jusqu’à l’oreillette. Grâce au cathétérisme on peut mesurer la pression, récupérer du sang, faire des injections… On peut même pousser jusque dans le ventricule droit et même jusqu’au tronc pulmonaire.
- La voie artérielle par cathétérisme gauche. Ce cathétérisme est plus difficile. Les artères étant profondes et la pression forte. Dans ce cas, on peut aller à l’entrée de l’aorte puis dans le ventricule (pas dans l’oreillette).
3 Mesure des débits.
a Chez l’animal, à « usage unique ».
On peut utiliser un débitmètre électromagnétique mais c’est un cas relativement rare.
On peut aussi utiliser des microsphères (méthode très utilisée mais définitive pour l’animal). Ces billes (ou microsphères) sont radioactives ou colorées. Elles ont un diamètre compris entre 10 et 15 micromètres et vont bloquer les capillaires.
Grâce à cette méthode, on n’a besoin que d’une petite partie du tissu étudié.
Avec les billes colorées, à t0, on utilise une première couleur, à t1, une seconde couleur, etc. … Finalement, on digère le tissu puis on passe ce qu’il reste au colorimètre.
Avec la méthode des billes radioactives, on n’a pas besoin de digérer le tissu.
b Chez l’Homme.
Doppler et Ecographie.
Chez l’Homme on mesure plus facilement la vitesse de la circulation sanguine que le débit.
La vitesse de circulation est obtenue grâce à l’effet Doppler.
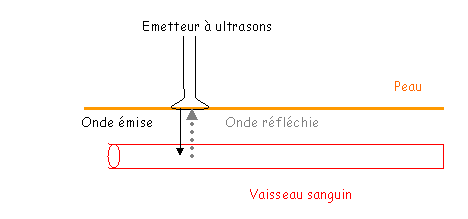
La variation de fréquence est proportionnelle à la vitesse de déplacement du sang dans les vaisseaux.
L’expérience donne une courbe à intégrer et peut donner la vitesse moyenne.
Après une écographie, on obtient la section des vaisseaux, puis le diamètre. On en déduit donc le débit grâce à l’écographie et au Doppler.
Méthode de Fick.
La méthode de Fick est un calcul permettant d’accéder au débit sanguin.
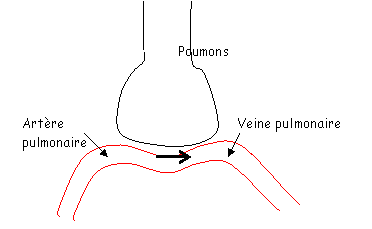
Pour faire ces calculs, il faut connaître la consommation d’O2 : VO2 = 250mL/min.
[O2] dans l’artère pulmonaire : 150mL d’O2/L (de sang)
[O2] dans la veine pulmonaire : 200mL d’O2/L (de sang).
Il y a 50mL de différence entre l’artère et la veine pour un litre de sang. Hors, 250mL d’O2 passent dans le sang chaque minute. On peut en déduire que 5 litres de sang passent dans les poumons par minute (c’est le débit).
La Pléthysmographie.
Le principe de cette technique est que l’on va mesurer la variation de volume d’un membre afin de déterminer le débit sanguin. Pour observer une variation de volume d’un membre (main…) on va bloquer le retour veineux, par exemple, par un garrot pour la main.
4 Mesures de volume.
La plupart du temps, les mesures de volume se font grâce à des techniques d’imagerie médicale (radiographie avec rayons X, écographie avec ultrasons, RMN [Résonance Magnétique Nucléaire] qui donne la meilleur définition, mais toujours en coupe).
5 Cas particulier de la fonction cardiaque.
a La fréquence cardiaque.
Pour la fréquence cardiaque, il faut distinguer la fréquence moyenne et la fréquence instantanée. La prise du pouls artériel se fait par l’arrivée de l’onde de pression et donne une fréquence moyenne. La mesure de la fréquence cardiaque par cardio-fréquence-mètre donne un enregistrement de l’activité électrique du cœur, ce qui permet d’obtenir une fréquence moyenne ou instantanée.
b Le volume d’éjection systolique (VES).
Le VES est le volume de sang quittant le cœur à chaque systole. La méthode par le calcul donne : Dc = Fc × VES ==> 5L/min. ˜< == 70 × 70mL
VES moyen = Dc/Fc
Une méthode instantanée est la radiologie qui permet la mesure de surfaces mais c’est une méthode peu fiable.
D Structure des appareils cardiovasculaires et relations avec l’appareil respiratoire.
1 Les poissons à respiration strictement branchiale.
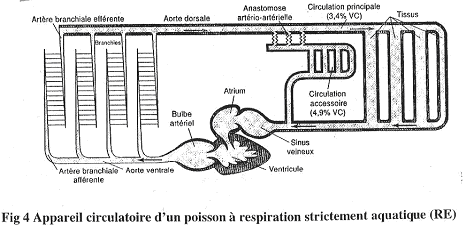
Le sang va du cœur aux branchies, puis aux organes et enfin, retourne au cœur.
Le cœur n’a que du sang désoxygéné.
Il ne faut pas oublier la présence d’une circulation accessoire. A partir de l’aorte dorsale se dérivent des anastomoses artério-artérielles qui détournent une partie du sang vers ce réseau secondaire.
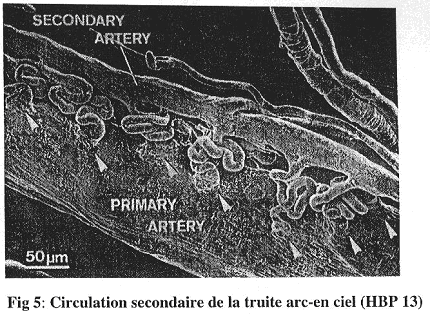
Cette circulation accessoire ne contient du plasma et a un rôle toujours inconnu.
2 Les poissons type Dipneuste.
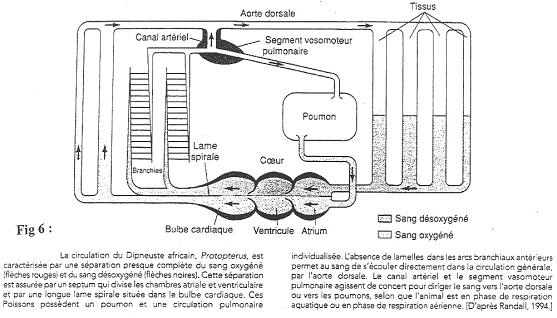
Certains poissons présentent l’apparition d’un poumon.
Ils respirent à la surface (quand l’eau comporte très peu d’oxygène). Au niveau du cœur, il va y avoir séparation des deux types de circulation.
Le sang des organes ne se mélange pas au sang arrivant des poumons. La séparation du sang désoxygéné et du sang oxygéné se fait grâce à l’action de la lame spirale qui est un début de cloisonnement.
Les deux premiers arcs branchiaux perdent les branchies. Des sphincters vont orienter le sang vers l’aorte (quand le poisson est dans l’eau) ou vers les poumons (quand le poisson est dans l’air).
3 Les amphibiens.
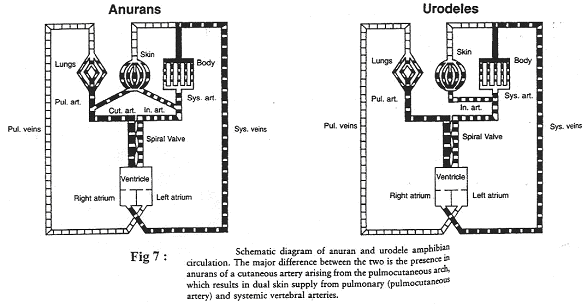
Les amphibiens peuvent avoir une respiration pulmonaire et/ou cutanée.
On observe une séparation anatomique avec les deux oreillettes et un ventricule. La lame spirale est le dispositif permettant de réduire le mélange des sangs.
a Les anoures.
Le sang venant des poumons s’enrichie en O2, arrive dans l’oreillette gauche et ne doit pas se mélanger au sang veineux arrivant dans le ventricule. Ce sang va partir vers les organes ou vers la peau. Dans ce dernier cas, il sera plus oxygéné.
Le sang veineux part préférentiellement vers le tronc pulmo-cutané.
b Les urodèles.
On ne trouve pas de tronc pulmo-cutané mais seulement une artère pulmonaire.
4 Les « reptiles ».
a Le cœur de tortue.
Le cœur de tortue présente deux oreillettes et un ventricule imparfaitement cloisonné.
On trouve le Cavum Pulmonale (CP), le Cavum Venosum (CV) et le Cavum Arteriosum (CA).
Le CP présente un début de cloisonnement.
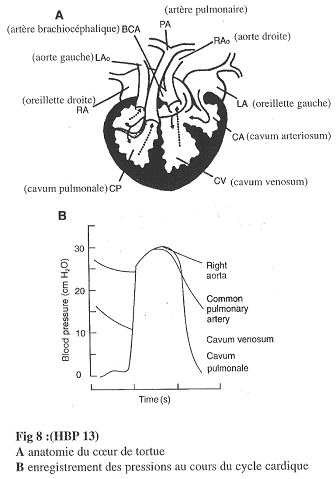
b Le cœur de Varan.
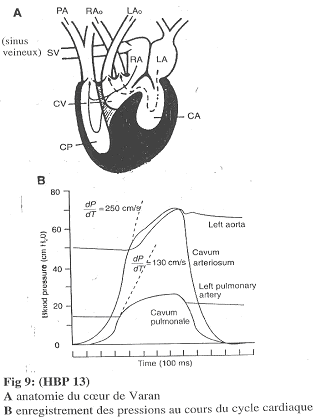
Le cœur de Varan présente deux oreillettes, un CP et un ensemble CV + CA.
Selon l’activité cardiaque, une cloison va bouger. En systole, cette cloison isole complètement le CP (la pression de part et d’autre de cette cloison devient alors différente). En diastole, il n’y a pas de cloison « parfaite ».
c Le cœur de Crocodile.
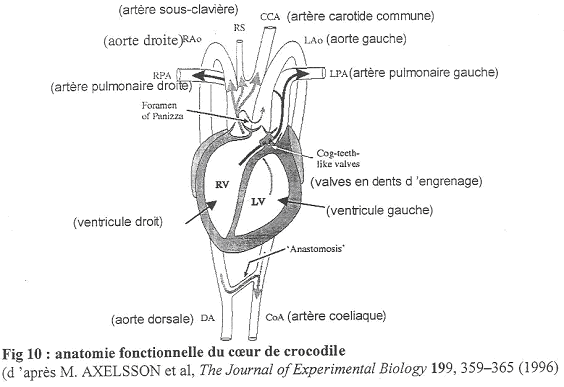
On distingue deux oreillettes ainsi que deux ventricules bien cloisonnés.
L’aorte gauche se fixe sur le ventricule droit alors que l’aorte droite prend son départ sur le ventricule gauche.
Remarques : Les reptiles ont toujours deux crosses aortiques. Ils présentent aussi plusieurs originalités :
- Le foramen de Panizza : il fait communiquer l’aorte droite et l’aorte gauche à leur départ des ventricules. Les mouvements de sang sont réalisés par la pression, ce qui fait que ce foramen peut être ouvert ou fermé. Le foramen de Panizza peut aussi être obturé par des valves artérielles.
- A la base de l’artère pulmonaire, on trouve une valve dentée qui peut être ouverte ou fermée, indépendamment des muscles (elle se ferme pendant une apnée). Cette valve permet le fonctionnement de l’aorte gauche.
5 Les oiseaux et mammifères.
Les deux circulations (pulmonaire, du ventricule droit et systémique, du ventricule gauche) sont placées en série.
La mise en place de ces deux circulations permet d’avoir des pressions différentes selon le réseau.
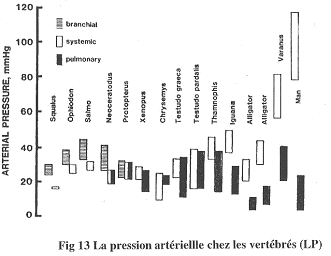
On étudie les pressions artérielles dans l’artère pulmonaire ou dans la branchie par rapport à la pression systémique.
Chez les poissons, la pression branchiale est supérieure à la pression systémique.
Chez les dipneustes et poissons associés, les pressions sont à peu près équivalentes.
Chez l’Homme, la pression systémique est largement supérieure à la pression pulmonaire. Le problème du poumon est qu’il est très vascularisé (environ 100m² chez l’Homme) et n’est une barrière de moins d’un micron d’épaisseur. Si la pression était trop forte, il y aurait un œdème pulmonaire qui pourrait être létal. Chez les crocodiliens et les varans, on trouve la même chose que chez l’Homme mais avec une moins forte amplitude.
Le cas particulier du fœtus :
Chez le fœtus, le poumon est non fonctionnel. Il existe deux dispositifs cardiaques permettant d’éviter d’envoyer du sang dans ces poumons.
- Le Foramen Ovale : Ce foramen est un trou entre les deux oreillettes. Le sang désoxygéné va rejoindre l’oreillette gauche, ce qui est tout simplement un court-circuit de la circulation pulmonaire.
- Le second dispositif prend en charge le sang qui est quand même passé dans l’artère pulmonaire. Ce dispositif va relier le tronc pulmonaire à l’aorte.
Finalement, une faible quantité de sang arrivera à atteindre le poumon.
A la naissance, le trou et le canal de dérivation se ferment.
II Physiologie Cardiaque.
A La pompe cardiaque.
1 Les Mammifères.
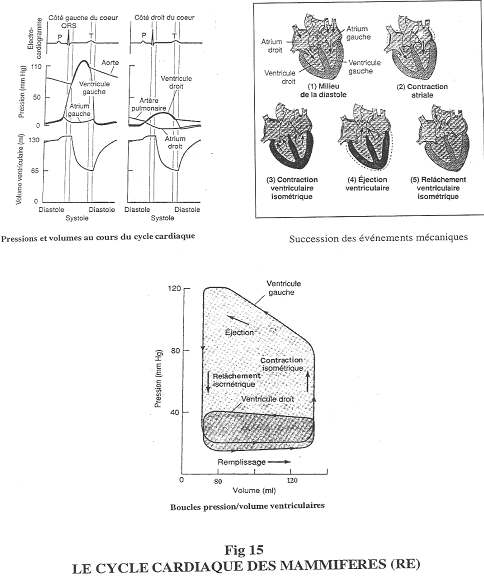
On étudie d’abord le volume ventriculaire, la pression. On réalise aussi un électrocardiogramme. Ces trois paramètres seront étudiés en fonction du temps.
La diastole montre une augmentation de volume. La systole montre, elle, une contraction avec diminution du volume ainsi qu’une augmentation de pression.
Au début, la contraction est iso volumétrique ==> fermeture des valves auriculo-ventriculaires.
Le ventricule se vide quand la pression ventriculaire devient supérieure à la pression aortique.
La systole est divisée en deux parties : une contraction iso volumétrique et l’éjection.
La pression va continuer à diminuer sans que le volume ne change ==> relâchement ventriculaire isoélectrique. Ensuite, le ventricule se remplie sous faible pression. A la fin du remplissage, il y a augmentation de la pression de l’oreillette gauche et une dernière augmentation du volume ventriculaire (grâce à la contraction de l’oreillette).
P : signal électrique pour la dépolarisation de l’oreillette.
Q, R, S : dépolarisation du ventricule.
T : repolarisation.
Du coté droit, on observe la même chose pour le ventricule. La pression est extrêmement faible dans l’artère pulmonaire.
Cf. figure 15, partie du bas :
Il n’y a pas de temps sur ce schéma.
2 Les poissons.
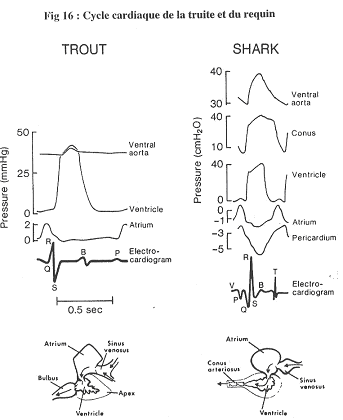
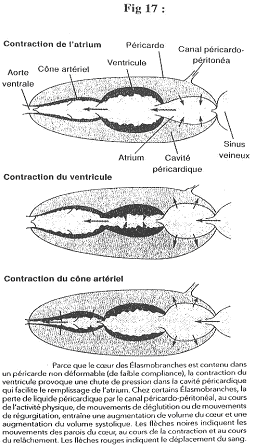
- La truite :
- Pour ce poisson, on trouve le même type d’enregistrement que chez les mammifères. La contraction de l’oreillette précède celle de l’éjection ventriculaire.
- Le requin :
- La contraction du cône artériel prolonge l’action du ventricule. La contraction de l’oreillette peut devenir négative (entre deux contractions). On dit négatif par rapport au milieu extérieur.
Dans ce cas, l’oreillette va donc aspirer le sang.
Dans le péricarde, la pression est toujours inférieure à zéro et inférieure à celle de l’oreillette.
La pression dans le ventricule diminue, ce qui entraîne une augmentation de la pression du péricarde. Hors, ce péricarde est rigide : quand le ventricule se contracte, il se crée donc une dépression à l’arrière qui aspire le sang et qui fait augmenter le volume de l’oreillette.
3 Les reptiles.
Revoir les figures 8 et 9.
La Tortue.
Le ventricule est peu cloisonné. S’il ne l’est pas totalement, la pression dans le cavum pulomonale (CP) est égale à la pression dans le cavum venosum (CV) et dans le cavum arteriosum (CA).
Par conséquence, il y a aura une augmentation de pression identique dans l’aorte droite ou dans l’artère pulmonaire (même pression dans les deux cas). Ce phénomène est un problème pour le circuit ventilatoire qui demande une basse pression.
Le Varan.
Chez le varan, il y a un cloisonnement étanche de temps en temps. En systole, le CP s’isole ce qui entraîne une augmentation de pression dans le CP qui est beaucoup plus faible que dans le CA. ==>La pression artérielle pulmonaire est inférieure à la pression aortique. On a alors une circulation à basse pression en série avec une circulation à haute pression.
Le Crocodile.
On trouve deux aortes (droite et gauche) mais l’aorte gauche ne va généralement pas recevoir de sang. De plus, au départ de cette aorte gauche, on va trouver une valve dentée. Entre ces deux aortes, il existe le foramen de Panizza qui laisse passer le sang de la haute pression vers la basse pression.
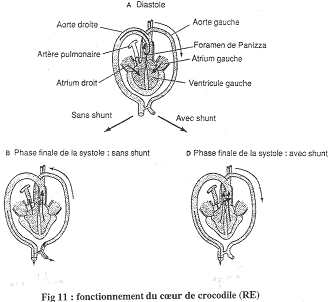
En A, on a la phase de diastole ; les figures B et D montre la systole avec un shunt en B et sans shunt en D. La pression est différente dans le ventricule droit et dans le gauche : elle est supérieure dans le ventricule gauche.
Le relâchement du cœur va permettre le remplissage par l’oreillette.
En A : Dans les aortes, le sang circule de l’aorte droite vers la gauche (la pression aortique droite est supérieure à la pression aortique gauche).
En B : Les ventricules doit et gauche se contractent. Le sang du ventricule droit passe dans l’artère pulmonaire mais la pression y est trop faible pour permettre le passage vers l’aorte gauche. Le sang du ventricule gauche part dans l’aorte droite. La valve sigmoïde vient se plaquer sur le foramen de Panizza et l’obstrue : il n’y pas de passage de sang.
En C : En plongée, il va y avoir fermeture de la valve dentée. La pression ventriculaire est inférieure à la pression aortique gauche. Ceci évite donc la circulation pulmonaire. Il y aura passage de sang (peu de pression dans le ventricule gauche) de l’aorte gauche vers l’aorte droite car le foramen de Panizza n’est pas fermé (avec shunt). On observe ainsi un court-circuit de la circulation pulmonaire.
B Le muscle cardiaque.
1 Structure d’un cardiomyocyte.
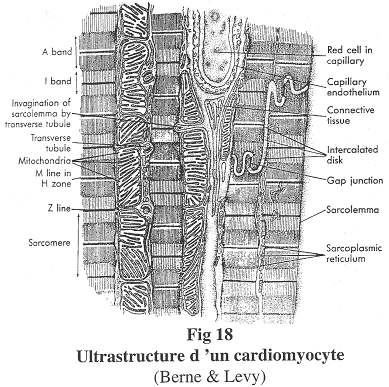
Les cardiomyocytes sont des cellules uni-nucléées. Elles sont dites striées car en microscopie optique, on observe des stries.
Ces cellules montrent des jonctions particulières : des jonctions pour la résistance et des desmosomes. On trouvera aussi des jonctions de type GAP qui jouent le rôle de synapse électrique ou de jonction communicante.
Bien que l’on ait plusieurs cellules différentes, la dépolarisation passe d’une cellule à l’autre sans intervention de neuromédiateurs (cela se passe comme si l’on n’avait qu’une seule cellule).
Les striations transversales montrent la présence de sarcomères qui sont des agencements particuliers d’actine et de myosine. Cet agencement est proche de l’agencement cristallin. De plus, tous les sarcomères sont alignés.
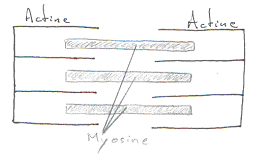
On trouvera dans ces cardiomyocytes de grandes quantités de mitochondries, des capillaires sanguins entre deux fibres, des disques intercalaires ou stries scalariformes (ancien terme) qui sont des jonctions entre deux cardiomyocytes. Les parois des cardiomyocytes sont proches mais ne se touchent pas. On a aussi un réticulum sarcoplasmique abondant qui permet le stockage de Ca2+, la libération de ce calcium pour l’action sur des protéines contractiles.
2 Propriétés du muscle cardiaque.
a Couplage électromécanique.
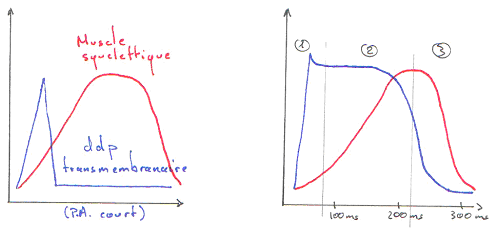
Le plateau du potentiel d’action dure aux alentours de 0,2 seconde.
La période réfractaire (PR) est la période pendant laquelle la structure ne réagit pas après avoir été stimulée.
La période réfractaire des muscles est de quelques millisecondes. Cette durée permet la fusion des contractions et la mise en place d’un tétanos ; ce qui est « normal » pour un muscle strié.
La période réfractaire du muscle cardiaque est longue. La période réfractaire absolue est d’environ 200 millisecondes : on ne peut donc pas tétaniser le muscle cardiaque.
Le potentiel d’action cardiaque est calcique alors que le potentiel d’action musculaire ou neuronal est sodique.
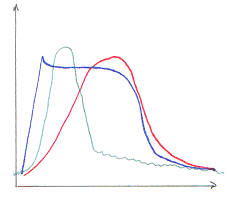
Pour mesurer la concentration en calcium dans la cellule, on va utiliser des sondes moléculaires comme l’Aequorine. Cette dernière devient fluorescente avec le Ca2+. La sortie de calcium (cardiaque) ressemble à celle du muscle strié squelettique.
Pendant la première phase, montée de potentiel, un canal électrosensible permet l’entrée de Na+ et s’ouvre quand la membrane se dépolarise : il va y avoir une boucle qui dépolarise la membrane.
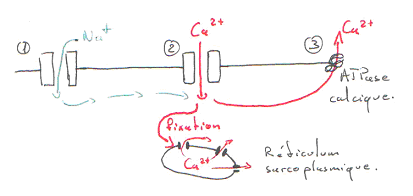
La phase de plateau est principalement due au calcium. Pendant la phase descendante, le calcium est pompé dans la cellule par une calcium-ATPase.
La différence de potentiel transmembranaire se passe de part et d’autre de la membrane. Les premiers ions calcium entrant (extracellulaires) vont aller stimuler la sortie de Ca2+ du réticulum sarcoplasmique. Ce canal à calcium est appelé RYR ou récepteur de la ryanodine (molécule végétale).
Le calcium cytoplasmique va aller agir sur les sarcomères, un peu comme dans le muscle strié squelettique. L’amplitude de la contraction va dépendre du niveau de Ca2+ du réticulum et de la sensibilité de l’appareil contractile, au Ca2+.
Le flash calcique est bref car ce calcium est re-pompé dans le réticulum par une calcium-ATPase (de type Serca).
Remarque : Dans le muscle strié, 50% de l’ATP est utilisé pour la contraction et l’autre moitié sert à faire rentrer le calcium dans le réticulum sarcoplasmique.
Les Serca peuvent être inhibées par le phospholamban (protéine complexe).
b Effets inotropes de la Noradrénaline.
L’action de la noradrénaline se fait sur la contraction du muscle cardiaque. Elle va augmenter cette force de contraction. La noradrénaline se lie sur un récepteur B2 adrénergique membranaire et entraîne la formation d’AMPc. Une PKa va être stimulée et va phosphoryler des cibles spécifiques :
- Canal calcium (qui voit son activité augmenter),
- Le PLB (phospholamban) qui est une protéine liée à la pompe Ca/ATPase, pompe qui fait entrer le Ca vers le réticulum endoplasmique.
Le calcium participe à l’augmentation de calcium dans le réticulum endoplasmique et permettant une plus forte vague calcique. Il agit aussi en stimulant la pompe, se qui fait rentrer le calcium dans le réticulum endoplasmique et ce qui raccourci ainsi la durée du flash (et un relâchement plus rapide). Dans ce cas, l’activité Serca augmente.
Finalement, on peut dire que tous ces effets entraînent un meilleur remplissage du cœur.
La phosophoryl-Troponine I diminue l’affinité du calcium pour la troponine C et qui entraîne donc une augmentation du relâchement de la fibre musculaire.
Remarque : Le cœur présente des récepteurs muscariniques pour l’acétylcholine. L’acétylcholine va diminuer la force de contraction. Ces récepteurs n’existent que dans l’oreillette.
Lors de stimulations par le système nerveux :
- Sur le ventricule, si la stimulation a pour origine le système nerveux orthosympathique, on observe des potentiels d’actions plus hauts et plus longs (la noradrénaline agit sur les canaux calcium).
- Sur le ventricule, le système nerveux parasympathique n’a aucun effet.
- Le système orthosympathique agit par un accroissement de la vitesse de contraction et de la force maximale. Il diminue la vitesse de décontraction (relâchement).
- Sur l’oreillette, les effets du système nerveux parasympathique sont opposés é ceux du système nerveux orthosympathique.
c Effet de la longueur du muscle cardiaque sur sa contraction.
Courbes tension/longueur.
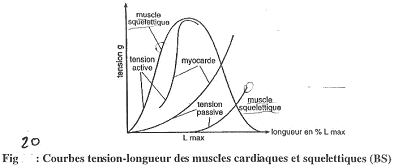
Une tension passive est une tension non provoquée par l’élément.
Une tension active est une tension réalisée par l’élément.
La relation entre tension et longueur est fonction de l’élasticité. Si les fibres sont peu élastiques, on aura beaucoup de tension alors que beaucoup d’élasticité entraîne l’existence d’une faible tension.
>Tension active : courbes en cloches.
On a une longueur maximale pour le meilleure contraction : elle est liée à la longueur des sarcomères.
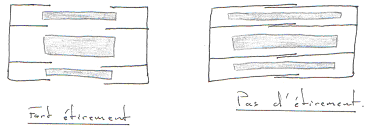
La force développée est fonction du nombre de liaisons actine/myosine.
Le muscle cardiaque développe une force passive tellement grande qu’il ne peut pas s’étirer plus (grâce aux fibres de collagène).
La notion de précharge : La précharge est la façon dont le muscle ventriculaire est étiré pendant la diastole ==>le remplissage conditionne la contraction.
C L’autonomie cardiaque et le contrôle de la fréquence cardiaque.
Notions de base : cf. DEUG.
L’origine de l’automatisme cardiaque est intrinsèque, comprise dans le tissu nodal (dans l’oreillette droite). Il y a stimulation de cellules en cellules dans le tissu auriculaire. Entre les oreillettes et les ventricules, on trouve du tissu isolant. La stimulation est relayée par le nœud auriculo-ventriculaire, puis le faisceau de Hiss et celui de Parkinje.
1 Origine et propagation de la stimulation.
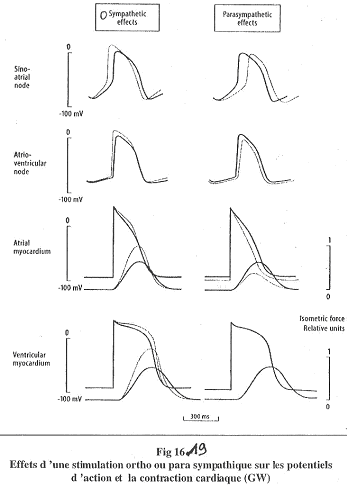
Dans la majorité des cellules, on a un potentiel de repos de l’ordre de -60mV. Dans les cellules du nœud sinusal, le potentiel de repos est instable, ce qui provoque des dépolarisations spontanées grâce à un canal responsable du courant entrant ==> IF (Na, K). IF s’ouvre à l’hyperpolarisation. Quand le seuil est atteint, la valeur atteinte permet l’ouverture de canaux voltage dépendants. Ici, ce sont des canaux calcium (voltage dépendants).
Il vient ensuite la phase de repolarisation par ouverture de canaux K. L’hyperpolarisation donne le début d’un nouveau cycle. La fréquence atteinte est d’environ 100 dépolarisations par minute.
Pour le nœud auriculo-ventriculaire, on trouve la même chose sauf que le fréquence spontanée est différente (environ 40 dépolarisation par minute).
Finalement, on trouve deux endroits capables d’automatisme mais seul le nœud sinusal s’exprime.
2 Effets des neuromédiateurs du système nerveux végétatif.
(Système nerveux parasympathique NAd, Système nerveux orthosympathique à ACh).
Une stimulation du système nerveux orthosympathique entraîne une augmentation du courant de fuite alors que l’acétylcholine (ACh) provoque l’inverse.
Le système nerveux orthosympathique va augmenter la vitesse de dépolarisation et donc accélérer le cœur.
Le système nerveux parasympathique diminue cette vitesse de dépolarisation et donc, ralentit le cœur.
Les effets chronotropes s’expliquent principalement par cet effet sur le courant IF.
La PKA augmente l’activité du canal IF par phosphorylation. Selon l’état de phosphorylation des canaux, les potentiels d’action seront plus ou moins importants.
L’ACh entraîne la présence de potentiels plus faibles et des repolarisation plus tardives. L’ACh a un effet direct sur les canaux K+ par l’intermédiaire de protéines Gk.
D Le débit cardiaque.
Dc = Fc x Ves
Pour un humain, Dc de repos est d’environ 5 litres par minute.
1 Notion de précharge.
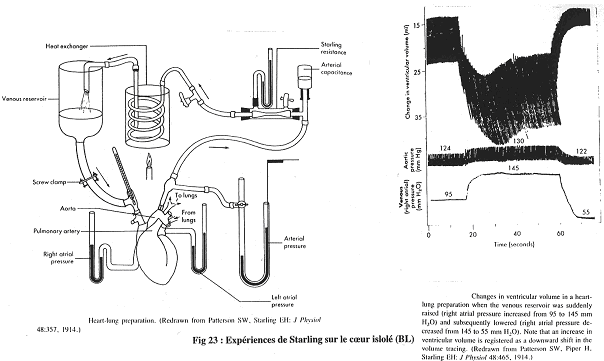
Sur cette expérience, on utilise un cœur isolé et perfusé de façon physiologique.
Le sang passe de l’oreillette droite au ventricule droit puis aux poumons ; il continue par l’oreillette gauche, puis le ventricule gauche et passe enfin dans l’aorte.
Sur le graphe, il manque le graphe du mécanisme de mesure du volume ventriculaire.
L’objectif de Starling est de voir si lorsque l’on augmente la pression de remplissage, le débit cardiaque (Dc) augmente.
Quand on monte le réservoir, la pression de l’oreillette droite augmente.
A 95, on a 1 hauteur.
Si la pression de remplissage augmente, l’étirement ventriculaire augmente, ce qui entraîne l’accroissement du volume d’éjection systolique (Ves).
Ves
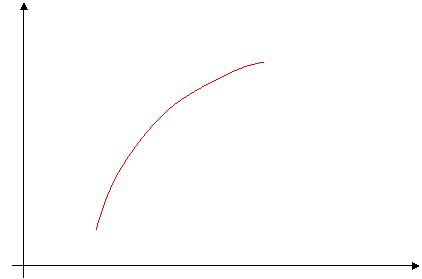
Volume télé-diastolique
Expérimentalement, pour augmenter le volume, on augmente la pression de remplissage (on peut trouver « Pression de remplissage » à la place du volume télé-diastolique).
Un effet de la précharge est que le temps de décharge est plus long : D – D’ ==> index de la contraction cardiaque.
Le Ves peut s’adapter par rapport au retour veineux (ce qui permet aux personnes âgées de pouvoir faire du « sport »).
2 Limitation du Ves par la postcharge : résistance.
La postcharge est tout ce qui s’oppose à l’éjection ventriculaire. Ici, on va jouer sur la pression de l’aorte.
La fonction d’éjection s’effectue quand la pression ventriculaire est supérieure à la pression aortique ; la pression artérielle diastolique agit constamment sur le ventricule.
Donc, si l’on augmente la pression artérielle, la valvule s’ouvrira plus tard, le ventricule se contractera donc aussi plus tard. La décharge devra également être plus rapide (car la pression artérielle est importante).
Les valves s’ouvrent plus tard et se ferment plus tôt : le phénomène d’éjection est plus court ; or, le travail cardiaque ne varie pas (l’aire ne change pas) mais c’est le système qui devient moins efficace. Si l’on veut obtenir un même Ves, il faut augmenter la contractilité, donc, le travail cardiaque. C’est ce qui arrive dans les cas d’hypertension artérielle.
Remarque : La fonction de postcharge dépend aussi des propriétés extensives de l’aorte.
3 La contractilité.
LA force de contraction dépend de la précharge (durée d’étirement).
La contractilité est l’aptitude à se contracter quel que soit l’étirement ventriculaire.
Ici, Ves augmente mais dans chaque cas, D, D’ et D’’ ne définissent pas une droite. Quand on a une augmentation de la contractilité, on augmente le travail du cœur même si la précharge reste identique.
4 Conclusion et réaction in vivo.
L’exemple de la Noradrénaline.
Cette molécule augmente la force de contraction, la fréquence, le remplissage (volume), mais aussi augmente le retour veineux et la postcharge : tous ces facteurs ne sont donc pas indépendants.
| Fréquence | Contractilité | Vitesse de conduction | Débit | |
|---|---|---|---|---|
| Orthosympathique | + | + | + | +++ |
| Parasympathique | – | 0 | 0 | — |
Pour le système orthosympathique, l’effet le plus marqué est sur la fréquence : de plus, la vitesse et la fréquence sont étroitement liées (propriétés voisines sues au tissu nodal).
Quand la fréquence est lente, la durée du cycle est grande et inversement.
Quand la fréquence augmente, la diastole est moins importante (moins de temps pour remplir le ventricule), donc, ici, l’effet relaxant de la noradrénaline est plus important.
En effet, si l’on se trouve à de hautes fréquences, c’est la diastole qui sera le plus affectée : la durée d’une systole diminue aussi mais bien moins, à cause de la vitesse et de la force de contraction.
La fréquence et la contractilité sont liées sur un cœur entier et la seule manière de les dissocier expérimentalement est faite par logiciel (Cf. TP).
E Métabolisme cardiaque et circulation coronaire.
1 Les endothermes.
a Le métabolisme du cœur.
Le métabolisme du cœur correspond à ses besoins.
C’est un métabolisme très aérobie où va se dérouler l’oxydation des nutriments, ce qui explique son fort taux de mitochondries (le plus fort du corps).
En période de repos, les substrats préférentiels de l’oxydation sont les acides gras libres (70%) avec 30% de glucides. Durant l’exercice, c’est un autre substrat qui va être oxydé : ce sont les lactates. Ces derniers proviennent des muscles squelettiques (environ 60%).
Le pourcentage de glucose dépend de la glycémie selon chaque individu.
Le métabolisme anaérobie est très peu développé dans la fonction cardiaque : le cœur se nécrose très vite, donc, si un problème a lieu dans la circulation coronaire, cela est très grave (infarctus).
b La circulation coronaire.
Il existe une circulation par ventricule.
La capacité d’anastomose est peu importante : en effet, un territoire de tissu cardiaque est irrigué par une seule voie ; donc, si une artère se bouche, tout un secteur ne sera plus irrigué (problème d’autant plus important que le barrage est en amont de la circulation).
L’artère coronaire pénètre dans la paroi des ventricules et lors d’une contraction systolique du ventricule, l’artère coronaire s’écrase (diminution du débit).
On assiste donc à une fonction paradoxale : lors de la systole, le débit est faible alors qu’en diastole, ce débit est plus fort. Quand la fréquence augmente, , la diastole diminue, donc, le temps d’irrigation coronaire diminue également. Toutefois, ce système fonctionne. Au repos, le débit de cette circulation est de 0,25L/minute. Durant l’exercice, ce débit passe à environ 1,3 litre/minute. Le débit coronarien s’adapte donc.
Si l’on prélève du sang dans l’artère et dans la veine pulmonaire, et que l’on mesure la PAV : le taux d’oxygénation du débit artério-veineux est toujours maximal, c’est-à-dire que le myocarde est un grand extracteur d’O2 et s’il doit consommer plus d’O2, sa seule solution est d’augmenter les débits coronariens. C’est une différence par rapport aux cellules classique qui ont toujours des réserves (le DAV n’est pas maximal).
2 Les ectothermes (reptiles, amphibiens).
a Le métabolisme du cœur.
Le problème chez les ectothermes est que le tissu cardiaque est en hypothermie : on assiste à des problèmes de fibrillations qui sont asynchrones au niveau de la contraction.
Ici, le cœur fonctionne en anaérobie, ce qui lui confère une résistance à l’anoxie et aussi, un affranchissement vis-à-vis de la température.
b La circulation coronaire.
Le cœur, en général, es poissons, n’a pas de circulation coronaire. Il possède des travées, ce qui lui confère des propriétés spongieuses : il s’imprègne de sang qui provient de la cavité péricardique. Le problème est que ce sang est pauvre en O2.
Au cours de l’évolution, certains poissons voient un système coronaire apparaître mais celui-ci est limité seulement à l’épicarde (juste la couche externe).
On peut donc considérer que a circulation pulmonaire a été sélectionnée chez les poissons car cela permet un avantage : il y a un apport de sang oxygéné dans la cavité péricardique et il ya donc augmentation de l’oxygénation cardiaque.
F Fonction endocrine du cœur.
L’hormone principale produite par le cœur est l’ANF (Atrium Natriurétique Factor ; vieux terme) ; c’est une hormone qui augmente la natriurèse (diminution urinaire de Na+). L’oreillette sécrète l’ANP (nouveau terme) quand elle est distendue. Cette distension est directement la conséquence de la volémie.
On trouve une boucle de régulation. Au niveau de l’oreillette, on a des volorécepteurs qui mesurent la volémie. Si cette dernière est excessive, il y aura sécrétion d’ANP (et natriurèse + diurèse juste après). La volémie reprendra ensuite une valeur normale.
Rappel : Les stimuli pour la synthèse d’ADH (hormone anti-diurétique).
On trouve comme stimuli efficaces : la pression osmotique hypothalamique et la diminution du volume des oreillettes. Récepteurs et organes sécréteurs vont participer à la synthèse et à la régulation hydrominérale.
III Physiologie vasculaire.
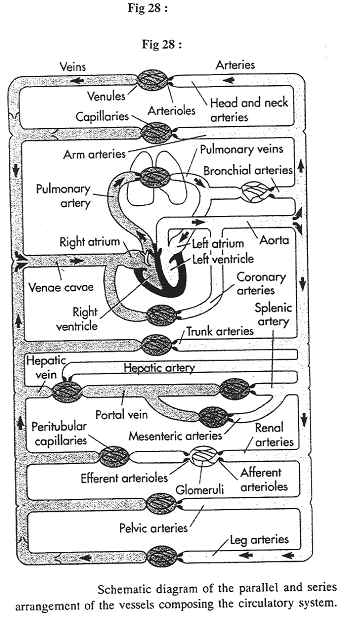
Revoir la figure 6.
Ce document montre les cotés gauche et droit égaux car parallèles.
Sur le document 28, on observe le système porte hépatique : on trouve une succession de deux réseaux de capillaires, ce qui est rare.
Au niveau du rein, on trouve des artérioles afférentes et efférentes séparées par des glomérules.
Au niveau du cœur, on va trouver un petit mélange de sang oxygéné avec du sang venant des veines bronchiques : les veines et capillaires bronchiques se déversent dans les veines pulmonaires : on peut différemment avoir 100% de saturation en O2 dans le sang.
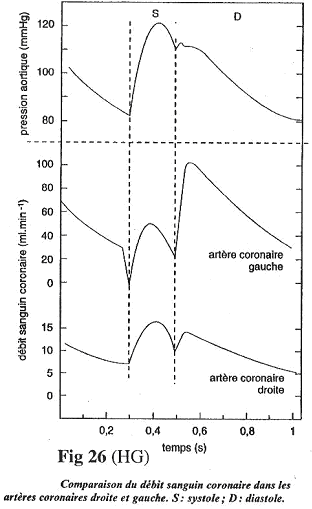
La circulation coronaire a la particularité, lorsque le cœur se contracte, de comprimer les artères coronaires (normal). Si on étudie le débit dans les artères coronaires gauches, on observe deux phases : une où la circulation est faible et une où la circulation remonte
L’irrigation du myocarde est essentiellement diastolique.
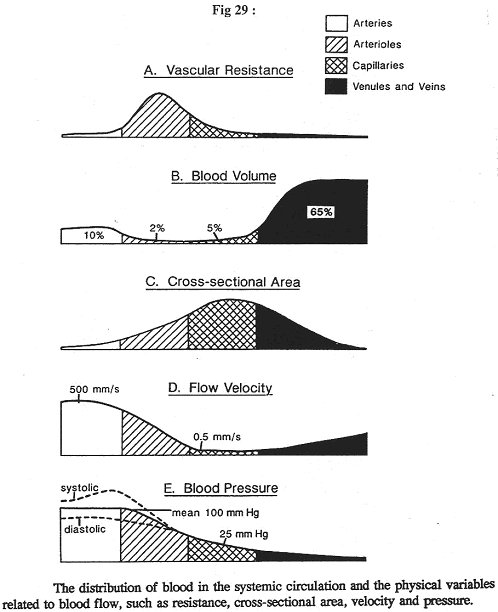
Dans cette figure, le sang circule de la gauche vers la droite.
En A, on étudie la pression moyenne. Elle diminue tout le temps, de l’entrée à la sortie : c’est ce qui fait avancer le sang. La diminution de pression est plus élevée à l’entrée qu’à la sortie. Elle ne remonte jamais.
Si l’on rajoute l’anatomie du système, on aura une surface de sections cumulées (surface de coté X nombre de vaisseaux) :
- Au niveau de l’aorte, la surface est multipliée par 1 (1 vaisseau).
- Au niveau des veines caves, on multiplie par 2
- Pour les capillaires, il faut multiplier par des milliards, ce qui montre une très grande surface de capillaires. Cette surface a une conséquence immédiate sur la vitesse du flux.
En D, le débit à l’entrée des capillaires est égal au débit au milieu et au débit de sortie. Or, si le débit est constant, la vitesse est très différente. La vitesse capillaire est 1000 fois plus faible que la vitesse dans l’aorte. Après les capillaires, il y a une ré-augmentation de la vitesse du flux sanguin.
A un moment donné, on se demande où est le sang. En fait, les 2/3 de la masse sanguine se trouvent dans le compartiment veineux où la pression est plus faible. Le système circulatoire n’est pas homogène.
Le sang artériel ne représente que 10% de la masse sanguine. De plus, il y est en mouvement à vitesse très rapide.
A Structure des vaisseaux.
1 Structure de base.
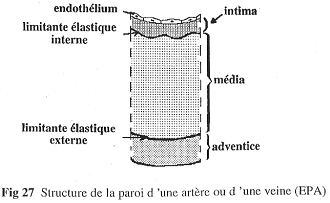
Les vaisseaux sont pratiquement tous sur ce modèle : trois parties (intima, média et adventice).
- L’intima :
- Cette partie est toujours présente. Elle est formée d’un endothélium très fin et très plat. On pourra trouver une couche sous-endothéliale qui se développe surtout avec l’âge. L’intima a la même structure embryologique que l’endocarde.
- La média :
- Cette partie est formée de cellules musculaires lisses et/ou de fibres élastiques.
- L’adventice :
- Dans cette partie, on trouve peu de cellules. On a surtout du collagène. C’est un « emballage » un peu rigide qui permet d’éviter les déchirements.
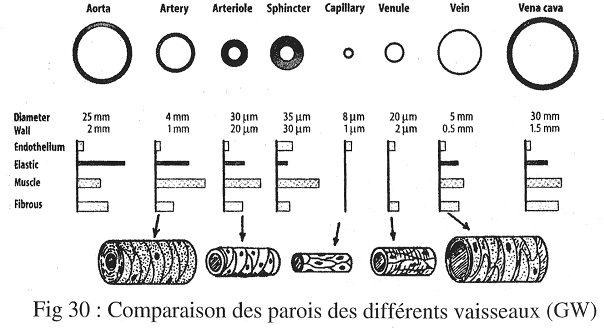
2 Comparaison des différents vaisseaux.
Pour comparer les vaisseaux, on a deux niveaux distincts : niveau fonctionnel et niveau histologique.
Au niveau histologique, on peut comparer une veine et une artère de même calibre (même débit) : l’artère a une paroi plus épaisse. Ceci est facile à voir car les veines et artères ont des structures voisines.
Si l’on regarde des sections de veines et d’artères, on s’aperçoit que dans les veines, l’adventice représente environ la moitié de la paroi, ce qui n’est jamais le cas dans les artères.
3 Evolution de ces structures.
Les grandes artères sont des artères élastiques car la média contient quasi uniquement des fibres élastiques.
Les artères de plus petits calibres sont dites musculaires car la média contient plus de cellules musculaires lisses que de fibres élastiques.
Les artérioles sont particulières car il n’y a plus d’adventice. On ne trouve plus que des cellules musculaires lisses et l’intima, cette dernière étant exclusivement formée de l’endothélium et de sa lame basale.
Entre les artérioles et les veinules, il existe un réseau de capillaires uniquement formés d’un endothélium (et de sa lame basale). Inégalement répartis, on trouve aussi des péricytes dont le rôle est peu connu (contraction, etc. …).
Il faut bien comprendre que ce réseau peut être constitué par anastomose ; tout dépend de l’ouverture et de la fermeture des sphincters. Tous ces réseaux capillaires ne sont pas ouverts en même temps. Ils sont ouverts en fonction des besoins.
Les veinules sont assez différentes des artérioles : l’adventice revient mais pas la média.
Dans les veines, la média revient mais elle est plus fine que l’adventice. La conséquence est que la force de constriction des veines est plus faible que celle des artères.
B Dynamique des fluides.
Les lois ont une limite dans leur utilisation car elle ne s’applique qu’aux fluides dont la viscosité est constante. Or, ici, les fluides ont des caractéristiques de différents paramètres : les lois de la dynamique des fluides ne s’appliquent pas partout mais elles permettent quand même d’expliquer certains phénomènes.
1 L’écoulement sanguin.
On distingue deux types d’écoulement : l’écoulement laminaire et l’écoulement turbulent.
L’écoulement laminaire se déroule comme si le liquide était divisé en strates glissant les unes sur les autres : on admet que ça peut être la réalité. Au contact du substrat, la vitesse devient quasiment nulle. Finalement, il se fait un gradient de vitesse (gradient laminaire). Dans un vaisseau sanguin, le profil d’écoulement est un peu différent : on a un profil parabolique.
Un intérêt de ce système est que la zone de frottements minimum est au niveau de la paroi car là, la vitesse est nulle (ou presque) et il n’y a pas (ou presque pas) de frottements. Un autre intérêt est la régularité de l’écoulement ainsi que l’absence de turbulences qui rompraient cet écoulement.
Dans le cas de turbulences, les profils de vitesse deviennent anarchiques et il y a aussi perte d’énergie par des chocs qui ne servent à rien. Les frottements obtenus par ses turbulences seraient la source de vibrations et de nombreux autres effets inutiles.
Quand l’écoulement devient turbulent, cela s’entend au stéthoscope (souffle au cœur).
Comment se fait le passage d’un type d’écoulement à l’autre ?
C’est le nombre de Reynolds (Re) qui permet d’expliquer le passage d’un courant à l’autre. Ce nombre dépend de la vitesse (V), du diamètre (D) et de la viscosité (µ) : Re = (V.D)/µ .
Moins un fluide est visqueux, plus le nombre de Reynolds est grand.
Pour un liquide donné, plus la vitesse d’écoulement est grande, plus il y a de risques d’y avoir des turbulences.
Pour une vitesse donnée et un liquide donné, plus le diamètre est grand, plus le risque d’avoir des turbulences est important.
Au niveau des artères on peut assister à la formation de sténoses, des pincements des artères. Comme le débit d’entrée est égal au débit de sortie et ceci, partout, les vitesses sont plus grandes au niveau des sténoses que de part d’autre de l’une d’elle.
Quand Re augmente, des turbulences sont créées et l’on peut donc entendre la circulation : on peut alors faire des mesures.
Les problèmes pathologiques liés à ces effets sont nombreux : on peut citer l’artériosclérose, surtout aux bifurcations.
2 La loi de Poiseuille.
Cette loi est similaire à la loi d’Ohm (U = R x I).
P = R x débit ==> Débit = D x P / r
En pratique : R = (8L x µ) / p x R4 .
L est la longueur du vaisseau, r est le rayon de ce vaisseau.
Donc :
- Plus le tube est long, plus il y a de résistance.
- Pour m, plus le liquide est visqueux, plus il y a de résistance.
- Pour r, plus le rayon est petit, plus la résistance est grande.
Il y a un fort impact du rayon sur la résistance de ces vaisseaux (puissance 4).
Si l’on s’intéresse à l’organisme en entier, globalement, la résistance ne varie pas qu’en fonction du rayon.
Revoir la figure 29.
On peut voir que les plus fortes résistances se trouvent dans les artérioles : c’est là où il y a une chute considérable du diamètre. Inversement, la chute de la pression sanguine, à ce niveau là, est due à l’augmentation de la résistance.
Au niveau des artères élastiques, il n’y a qu’une résistance extrêmement faible ==> la diminution de pression artérielle moyenne est donc quasiment nulle.
La tension :
Remarque : Quand on parle d’hypertension, en réalité, on parle d’hyper pression !
Les notions de pression et de tension ne sont pas identiques : la confusion des deux est un abus de langage.
T = P x r (T est la tension ; P la pression ; r le rayon).
Plus la pression augmente, plus la tension augmente. On a la même chose quand le rayon augmente. Dans le cas de fortes viscosités, il se développe une tension plus forte.
Par exemple, dans les artérioles, il se développe une pression élevée (le ¼ de la pression aortique) pour une paroi 100 fois plus fine. Cette paroi ne se déchire pas car ici r est petit et T est donc faible.
Dans le cas de l’aorte, on se trouve dans des conditions maximales : le diamètre est le plus grand possible et la pression, la plus forte possible. Il n’y a pas de déchirement car la paroi est très solide (composée de fibres élastiques).
C Hémodynamique (dynamique des fluides appliquée au sang et aux vaisseaux).
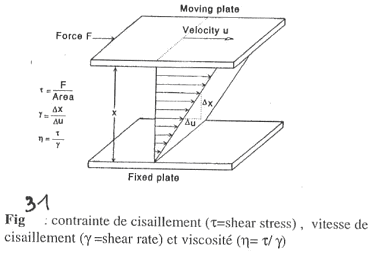
La plaque du dessus se déplace par rapport à celle du bas qui est fixée. On va ensuite définir la vélocité de la plaque supérieure en fonction de la surface et des forces développées.
t = F / Aire (S) ==> on obtient la dimension d’une pression. Mais il faut faire attention car F est tangentielle car c’est une force de cisaillement.
g est la « shear rate » ou vitesse de cisaillement. D.u est la différence de vitesse alors que D.x est le gradient de vitesse.
==> h = t / g. Cette valeur (h) diminue (donc les frottements) quand g augmente. En pratique, plus le sang circule vite, moins celui-ci est visqueux (= comportement rhéo-fluidifiant). Par exemple, la peinture est de moins en moins visqueuse quand on la mélange de plus en plus.
Quand la vitesse est faible, on obtient un empilement de globules rouges, ce qui rend le sang très visqueux. Au fur et à mesure que g augmente, les interactions entre globules rouges changent et il y a dissociation et donc, fluidification (h diminue).
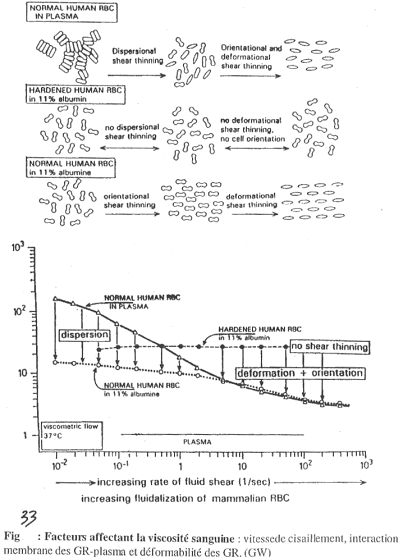
On observe sur ce graphe la viscosité relative par rapport à celle du plasma qui est donnée à une valeur de 1.
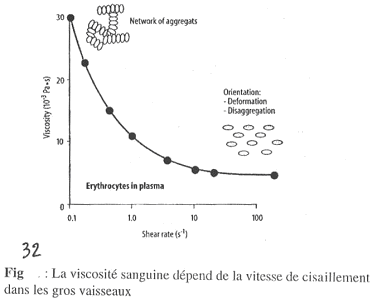
Sur ce graphe, on observe la viscosité réelle.
Sur la figure 33, les triangles blancs représentent la courbe normale, avec les globules rouges en suspension dans le plasma (sang normal).
La courbe désignée par les ronds blancs représente des globules rouges humains normaux en suspension dans une solution d’albumine : 11% d’albumine représente 110g/L et donne une valeur de h égale à celle du plasma).
Avec de fortes valeurs de g, on ne voit pas de différence avec la courbe normale.
Pour de faibles valeurs de g, l’accroissement de h n’est pas très important car il n’y a pas d’agrégation des globules rouges car les protéines plasmatiques nécessaires à cette agrégation sont absentes.
Pour la courbe désignée par des ronds noires, on ne prend pas de globules rouges normaux mais des globules rouges durcis par le glutaraldéhyde. Ces globules ne sont pas déformables et les empilements sont maintenant impossibles. Ces globules rouges sont dans de l’albumine.
Pour de faibles valeurs de g, il n’y a pas d’augmentation de h.
Pour de forts g, il n’y a pas de diminution de h : aux fortes valeurs de g, le globule rouge passe d’une forme bicaténaire à une forme ovoïde. C’est une orientation de la circulation. Cette mise en forme ovoïde est inhibée dans ce cas par le glutaraldéhyde.
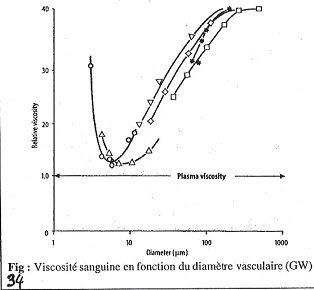
Ce document permet d’étudier l’influence du diamètre sur la viscosité sanguine. Il faut bien remarquer que la fluidité du plasma ne varie pas avec g.
Sur cette figure, quand un vaisseau a un diamètre de 1000mM, on a h qui est 40 fois plus grande que celle du sang.
S’il y a diminution du diamètre, h va diminuer. On a ceci jusqu’à 10mM où l’on trouve la valeur de h minimale.
Dans les petits vaisseaux, la viscosité du sang devient proche de celle du plasma (attention, 10mM n’est pas le plus petit diamètre existant).
Quand le diamètre diminue, on observe la chute de h ; cette chute est due à une séquence de phénomènes qui se déroule : les globules rouges se trouvent au milieu et le plasma autour.
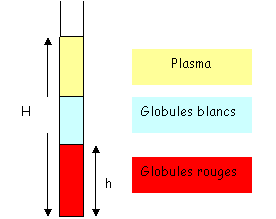
Il y a un élément très important : l’hématocrite. Pour calculer cette hématocrite, on prélève une goutte de sang que l’on place dans un tube très fin de 7 à 8 centimètres de long pour un diamètre de 0.25 millimètre. On centrifuge et l’on mesure les hauteurs.
L’hématocrite (Ht) est égale à h/H. plus il y a de globules rouges, plus la viscosité sera grande.
L’hématocrite moyenne est de 0.45. Le maximum autorisé est de 0.5. Les problèmes liés à l’hématocrite sont surtout circulatoires : on peut trouver de graves thromboses arrivant à provoquer la mort.
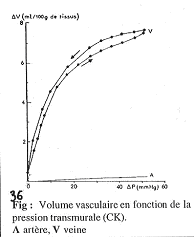
Les parois des vaisseaux ont plus ou moins de couches et sont plus ou moins étirables. Ces vaisseaux sont des organes creux et ont donc une compliance : DV/DP.
Comparaison de la compliance des veines et des artères.
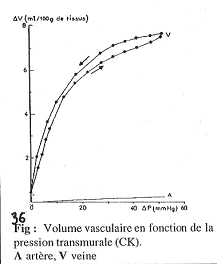
La compliance est la pente des courbes ; quand le maximum est atteint, la compliance est nulle. On observe que les veines ont toujours une compliance beaucoup plus élevée que les artères. Cette observation doit toutefois être nuancée.
En effet, on trouve des différences de pression entre les veines et les artères : Si l’on se met à pression élevée dans les deux systèmes, on observera que dans les veines, la compliance devient très faible, voir nulle.
Dans les veines, cette forte compliance permet une augmentation de volume dans le cas des fortes pressions (pressions restant d’ordre physiologique).
Les vaisseaux sanguins sont doués d’une certaines contractilité.
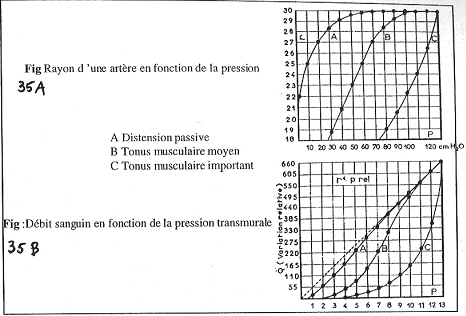
Dans le document A, sur la courbe A, on observe une distension passive. A l’atteinte de la valeur maximale, on se trouve au maximum d’étirement.
Sur la courbe B, Si le tonus musculaire augmente, le rayon va diminuer et faire obtenir une nouvelle compliance.
Sur la courbe C, le tonus musculaire est encore plus fort : on obtient une nouvelle courbe de compliance mais celle-ci ne devient jamais nulle !
Dans le document B, on mesure maintenant le débit, et non plus, le diamètre. Normalement, le débit est fonction du diamètre et de la pression. On s’attend donc à obtenir une droite. La pente dépend de R et donc, du rayon.
Or, ceci n’est vrai que pour de fortes pressions et pas pour les petites. En fait, on a une diminution de la pression, et du rayon, ce qui fait chuter le débit. Il y a fusion quand le diamètre ne dépend pas de la pression.
Si en plus, on a contraction, le diamètre diminue encore, ce qui fait encore diminuer le débit.
Tension et rayon : que ce passe-t-il lorsque l’on envoie dans un vaisseau, du sang sous pression croissante ?
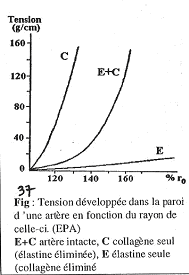
La compliance des vaisseaux fait que le volume augmente grâce à un étirement de la paroi qui subit certaines tensions.
Dans ce cas, la tension est fonction du rayon du vaisseau. La relation les unissant n’est toutefois pas linéaire. La courbe de résultats obtenus est relativement plate au début puis devient de plus en plus raide : on début, quand on tire sur la paroi la tension est faible, mais, plus on tire, plus la tension s’accroît. (Courbe E+C)
Si jamais on enlève le collagène du vaisseau, on obtient la courbe E : très peu de tension se développe.
Si l’on enlève l’élastine et que l’on garde uniquement le collagène, on obtient la courbe C montrant que le moindre étirement provoque une augmentation très importante de la tension.
En pratique, quand on a C+E (collagène et élastine), les éléments se mettent en jeu par l’action de l’élastine. Le collagène n’est pas étirable par lui-même : les mailles sont peu déformables sans tension. Il sert à protéger la paroi si la tension devient importante trop vite.
On peut faire une analogie entre le ballon de baudruche et le filet formé par le collagène et l’élastine :
- l’élastine développe peu de tension mais ne donne pas de rigidité au système ;
- le ballon est gonflé jusqu’à arriver à une position où il ne se déforme plus ; comme le filet.
L’action du tonus vasomoteur sur la tension.

Quand les vaisseaux se contractent, on reste sur la droite de P2 ; on passe à un rayon plus faible mais la tension diminue : cela préserve des déchirures lors des grandes pressions.
La vasoconstriction décale la courbe vers la gauche.
Il faut faire attention car, à rayon égal, la vasoconstriction augmente la tension !
(Les deux droites ont des pressions identiques).
Notion de contraintes pariétales (subit par la paroi).
Il y a des déchirements car les vaisseaux ne peuvent pas supporter de trop grandes pressions. L’épaisseur de la paroi est importante pour prévenir ces cassures : ce qui compte est le rapport entre T (que rapporte le vaisseau) et h (l’épaisseur) (T/h).
La tension est égale au rapport de la pression sur le rayon (T=P/r). Ce qui compte est la pression puis le rapport du rayon sur l’épaisseur de la paroi (r/h).
Lors d’une vasoconstriction, le rayon (r) va diminuer et comme l’on a la même quantité de matériaux, on va avoir l’épaisseur (h), qui augmente et fait ainsi diminuer la tension exercée sur la paroi : c’est un système de protection.
D La circulation artérielle.
Dans cette circulation, on distingue deux domaines : les artères élastiques (aortes et grosses artères) et les artères musculaires.
1 Les artères musculaire.
Ces artères sont riches en fibres élastiques et pauvres en cellules musculaires. Leur rôle est de régulariser le débit car le cœur est une pompe discontinue et les organes ont besoin d’un flux continu.
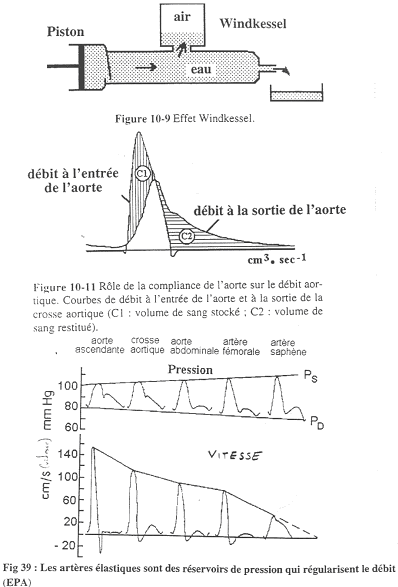
On suit le trajet des artères.
A la sortie du cœur, la vitesse atteint un maximum élevé mais ensuite, elle s’annule et arrive même à s’inverser. Dans les artères saphènes, le débit ne s’annule plus mais n’est pas régulier (toujours pas régulier). Si les artères étaient rigides, on n’aurait un écoulent sanguin uniquement pendant la systole.
Sur la figure du haut (10-9), quand on pousse le piston, tout ne sort pas en même temps : il y a un stockage par compression de l’air. Quand le piston recule, il y a écoulement car l’air comprimé pousse le liquide. Il faut bien faire attention au fait qu’il n’y ait pas d’air dans l’aorte ! Le rôle de l’air est joué par l’élasticité de la paroi de l’aorte.
Sur la figure 10-11, on voit que les débits ne sont pas superposés : la moitié du sang est stockée alors que l’autre moitié s’écoule.
Sur la figure du as, on observe l’enregistrement de la pression dans les artères élastiques.
Plus on s’éloigne du cœur, plus la pression systolique augmente, alors que la pression diastolique diminue. Finalement, on a alors la pression artérielle moyenne qui diminue très lentement (très peu).
La pression systolique augmente par une sorte d’artefact.
Quand le cœur met le sang sous pression, l’onde de pression se déplace plus vite que le sang. Cette onde de pression va être réfléchie et il va y avoir des croisements qui vont donner des interférences représentées soit par des soustractions, soit par des additions d’ondes.
L’aire sous la courbe de chaque période est inférieure ou égale à la précédente.
2 Les artères musculaires.
(Vrai aussi pour les artérioles).
Ces artères sont douées de vasomotricité. Elles sont aussi appelées « artères de distribution ». La vasomotricité intervient pour la régulation de la pression artérielle.
Pa=Dc x RPT
RPT dépend du diamètre des vaisseaux.
Le contrôle des muscles lisses vasculaires dépend du système nerveux orthosympathique. Parfois on a des terminaisons nerveuses cholinergiques, mais seulement pour quelques rares organes. Le système nerveux orthosympathique entraîne la vasoconstriction.
Cette vasoconstriction sert aussi à la thermorégulation.
Pendant une réaction inflammatoire, il va y avoir vasodilatation.
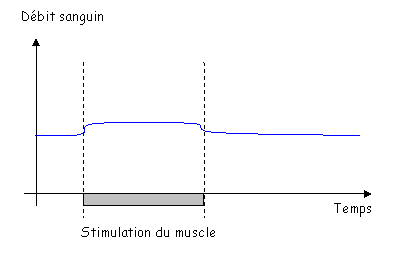
a Vasodilatation débit-dépendante.
(Vasodilatation induite par le flux sanguin).
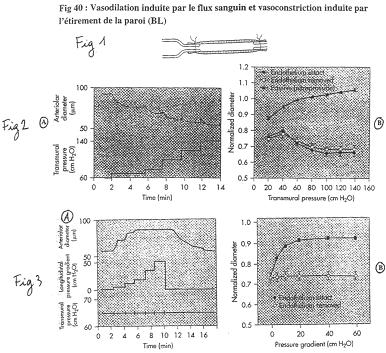
On prend une artère où le débit sanguin augmente graduellement (par palier).
Sur la figure 3, on fait varier le débit sans modifier la pression transmurale.
Pour le diamètre de l’artère : quand il y a augmentation de circulation, on observe une vasodilatation. Sans endothélium, la vasodilatation débit-dépendante est supprimée : on a donc besoin de la totalité de l’endothélium (besoin de son intégrité).
L’endothélium sécrète du NO qui est vasodilatateur
Si l’on remplace le sang par un liquide de plus en plus visqueux, on va faire augmenter la vasodilatation. Si l’on rigidifie les cellules endothéliales, on observe qu’il n’y a plus de vasodilatation débit-dépendante.
C’est le « Stear Stress ».
C’est la déformation de la cellule qui est perçue et qui déclenche la libération de NO.
Si les vaisseaux ont un débit qui augmente, la vitesse va augmenter, comme les frottements. Le diamètre augmente, ce qui fait diminuer la vitesse. C’est une boucle de régulation (c’est le rôle fondamental de l’endothélium).
b La vasoconstriction myogénique.
Revoir la figure 40.
Dans cette expérience, le sang ne circule pas, le débit est donc de 0.
On augmente la pression transmurale par paliers. A chaque palier, les artères vont avoir une petite dilatation, puis une réduction du diamètre. Plus l’artère reçoit de pression, plus le diamètre diminue. Si l’on empêche le muscle de se contracter, le diamètre augmente.
Sans endothélium, on observe les mêmes phénomènes.
Quand on étire les cellules musculaires lisses, il y a contraction. Dans la paroi, on a des canaux sensibles à l’étirement : ils permettent l’entrée de calcium, dépolarisation et contraction.
Le principal intérêt et le tonus vasomoteur : contraction un peu permanente. Ce tonus permet d’augmenter l’épaisseur et le diamètre et ce qui diminue les contraintes.
Ce tonus protège du déchirement.
Le passage de la position couchée à debout.
Une trop forte pression dans les capillaires entraîne la formation des œdème. Il y a une limite entre vasodilatation et vasoconstriction réflexe en aval.
E Vasodilatation métabolique.
L’irrigation d’un tissu s’adapte aux besoins de ce tissu. Le phénomène est assez général mais difficile à étudier saut sur les muscles.
1 L’hyperhémie réactionnelle.
On provoque une occlusion et l’on mesure le flux sanguin dans le vaisseau.
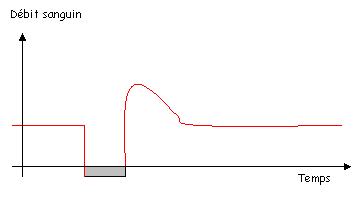
Ce mécanisme est peu connu.
Pendant l’occlusion, on aura une hypoxie et une hypercapnie (trop de CO2), le pH chute. Ce sont tous des stimuli vasodilatateurs, avec des mécanismes d’action différents.
2 L’hyperhémie fonctionnelle.
Cette hyperhémie est mise en évidence facilement dans un muscle.
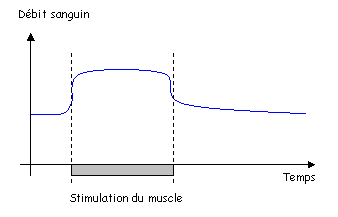
Très rapidement, la vasodilatation se produit mais trop vite pour les facteurs cités précédemment. On ne sait pas très bien ce qu’il se passe.
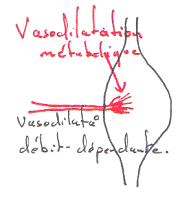
Ce mécanisme a été étudié là où le muscle et l’artère sont collés.
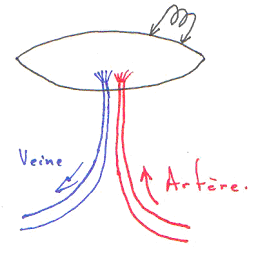
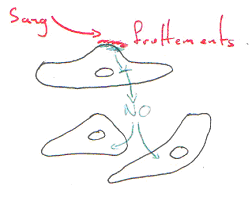
Souvent, on voit que les artères et les veines sont collées.
Si l’on détruit l’endothélium de la veine, on aura une hyperhémie bien moindre.
L’endothélium de la veine peut produire du NO et le faire diffuser dans l’artère. L’endothélium est un « capteur ». L’endothélium de la veine, par son endothélium, produit du NO qui va agir sur l’artère associée.
Ce phénomène n’existe pas dans tous les cas.
On trouve aussi une régulation métabolique à la place de mécanisme dans les petits vaisseaux, voir même dans des organes.
L’intérêt de ce mécanisme est d’éviter le collapsus artériel. Cela regroupe plusieurs nécessités.
Si l’on augmente la pression en amont, on va augmenter le débit.
Selon les organes et la situation, on a soit une vasoconstriction soit une vasodilatation.
F Le muscle lisse vasculaire.
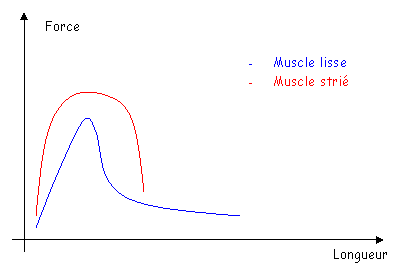
Le muscle lisse vasculaire présente des différences avec les muscles striés :
- Il n’y a pas de sarcomères.
- Il y a présence d’actine et de myosine, mais sans organisation géométrique : les filaments sont dispersés. Cette position présente un avantage : la fibre musculaire lisse est moins dépendante de sa longueur que la fibre musculaire striée.
Comme dans le muscle cardiaque, les cellules sont reliées entre elles par des jonctions GAP : elles se stimulent les unes les autres (il n’y a pas de plaque motrice dans le muscle lisse). Les terminaisons du système nerveux orthosympathique forment des varicosités (des vésicules) et ne stimulent que quelques cellules qui vont stimuler leurs voisines…
La force développée par le muscle lisse peut être aussi forte que celle développée par le muscle strié mais cette contraction sera beaucoup plus lente.
Le muscle strié est relâché ou contracté. Le muscle lisse a des états intermédiaires : des états verrouillés. Dans ces états verrouillés, le muscle se maintien dans l’état intermédiaire choisi sans consommer d’énergie.
Le muscle strié et le muscle cardiaque se contractent toujours grâce à un potentiel d’action : le muscle lisse non ! Il peut se contracter grâce à un potentiel d’action ou non.
Dans les muscles lisses, le Ca2+ joue un rôle dans la contraction. Dans ce cas, l’intervention du calcium se fait grâce à un couplage avec la calmoduline.
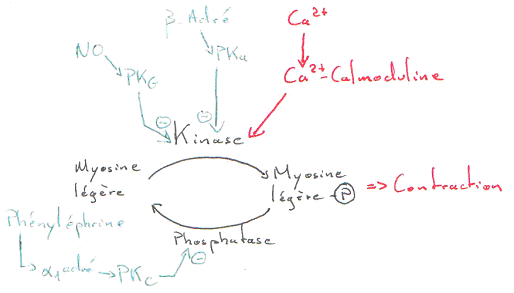
La concentration en calcium est modulable par un ensemble d’enzymes qui interviennent à divers niveaux.
Le NO (vasodilatateur) permet l’accumulation de GMPc (qui active la PKg). Cette PKg phosphoryle la kinase et l’inhibe.
La phényléphrine est un agoniste des récepteurs a1-adrénergiques : ils sont couplés à la PLC et donnent de l’IP3 et du DAG. Ce DAG va activer la PKc. La contraction est favorisée.
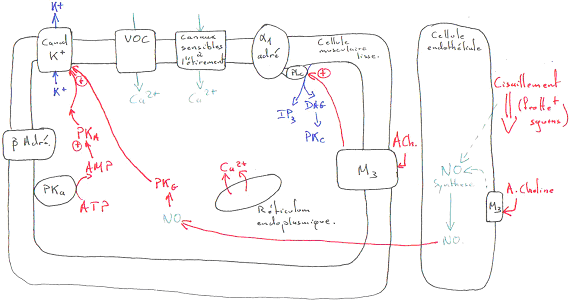
Remarque : il y a le problème de l’existence de M3 car l’acétylcholine n’est pas une hormone ; c’est un neuromédiateur, mais cela fonctionne…
L’acétylcholine, sur l’endothélium va entraîner une vasodilatation alors que sur les cellules musculaires lisses, elle entraîne une vasoconstriction.
Les vaisseaux sanguins sont innervés par le système nerveux orthosympathique alors que l’acétylcholine est libérée par le système nerveux parasympathique.
La noradrénaline a une action différente selon le récepteur sur lequel elle se fixe : elle donne une vasoconstriction en se fixant sur le récepteur a1 et une vasodilatation en se fixant sur le récepteur b.
Dans la plupart des artères, l’activité a1 est prédominante, mais ce n’est pas le cas partout (surtout dans les artères des muscles striés). Les artérioles ont principalement des récepteurs a alors que les artères des muscles striés ont plutôt des récepteurs b.
G La microcirculation (ou circulation capillaire).
1 Organisation d’un réseau capillaire.
Beaucoup d’études ont été faites en 2 dimensions alors que la majorité des réseaux est en trois dimensions.
Les artérioles donnent des métartérioles et des boucles capillaires sont branchées sur ces métartérioles. A la base de chaque départ, on trouve un sphincter pré capillaire.
On a aussi des anastomoses veineuses qui permettent de détourner le sang. La vitesse dans les capillaires est lente, 1000 fois plus lente que dans l’aorte. Les échanges sont surtout des échanges nutritifs.
2 Structure des capillaires.
En a, on voit des capillaires continus, comme dans les muscles. L’O2 et le CO2 diffusent. On a des fentes minces pour quelques échanges. Il existe aussi le transport transendothélial (pinocytose).
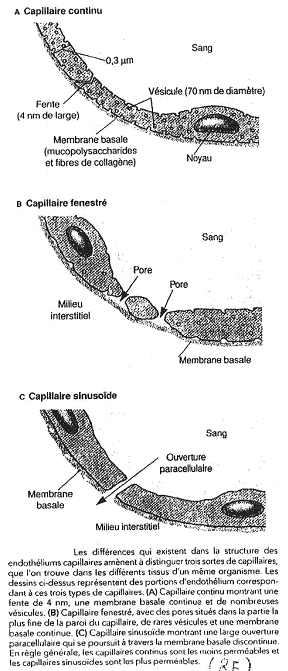
Sur la figure b, on a le cas des capillaires fenestrés des reins. Il existe un fort débit dans les trous ainsi qu’une sélectivité de la lame basale.
La figure c représente des sinusoïdes, trouvés dans le foie et dans les os. Il y a une erreur sur ce document : il n’y a pas de lame basale dans les sinusoïdes.
Les capillaires font une filtration permanente des liquides, ce qui est la conséquence de la nutrition. Le liquide va sortir du capillaire (par les protéines) et avec ce liquide, sort tout ce qui peut passer au travers de la paroi.
La plupart du temps, c’est du plasma sans protéines qui sort.
La pression oncotique du plasma (ou pression plasmatique des protéines) s’oppose à la filtration.
Au début, la pression sanguine est supérieure à) la pression oncotique mais au fur et à mesure, la pression sanguine devient inférieure à la pression oncotique, ce qui entraîne la réabsorption.
La filtration dans les capillaires représente un volume de 20 litres par jour. La réabsorption représente, elle, 18 litres par jour. On a finalement une différence de 2 litres par jour.
Ces deux litres restant sont drainés par les capillaires lymphatiques et donnent la lymphe.
C’est la conséquence de la pression élevée et de la perméabilité du capillaire.
H La circulation veineuse.
Les veines ont une compliance élevée aux basses pressions.
 .
.
Cette compliance entraîne le remplissage. Quand elles se vident, les veines s’aplatissent : le volume du compartiment veineux est donc variable.
Les veines ont une possibilité de veino-constriction, qui compte beaucoup pour le retour veineux. Elles ont aussi de nombreuses valvules anti-reflux.
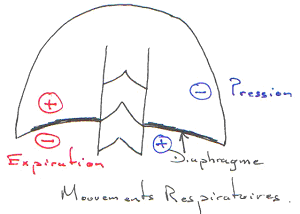
Le retour veineux au cœur dépend de la différence de pression entre les veines et l’oreillette. Le problème existant est qu’il y a très peu d’énergie participant au retour veineux. L’énergie vient de la contraction du cœur qui fait un appel de sang. Une autre source d’énergie est la constriction des veines (structures qui aident au retour) ; les muscles striés squelettiques et les mouvements respiratoires aident fortement à faire remonter le sang au cœur.
Les veines sont des structures où règnent de basses pressions : les contractions font écraser les veines. L’augmentation de pression obtenue par l’écrasement, en arrière de la veine entraîne la fermeture de la valvule et en avant, il y a ouverture de la valvule.
Les mouvements respiratoires aident à la remontée du sang (l’inspiration).
IV Physiologie cardio-vasculaire intégrée.
A Le couplage cœur/vaisseaux.
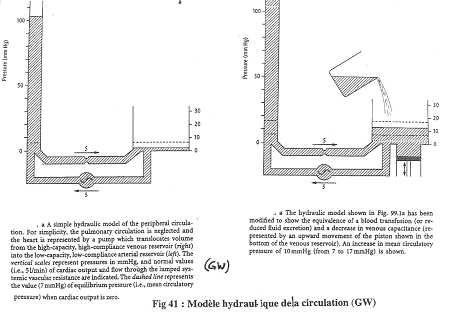
On considère que l’appareil cardio-vasculaire est représenté par le montage.
Si le cœur s’arrête, on obtient la même pression dans les artères que dans les veines. Le niveau atteint est la pression de remplissage : cette pression ne dépend que du volume sanguin (de la volémie). Chez l’Homme, cette pression de remplissage est de l’ordre de 7 millimètres de mercure (7mm Hg).
Si le débit de la pompe augmente, la pression dans le compartiment artériel augmente mais diminue dans le compartiment veineux : on atteint la débit cardiaque maximal où le sang dans le compartiment veineux est absent.
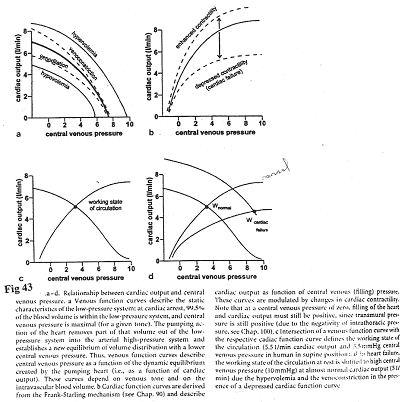
En a, on observe les effets du débit cardiaque sur la pression veineuse.
Sur le document 41, à droite, on a un compartiment veineux à capacité variable. La veino-constriction est représentée par une montée du piston et la veino-dilatation est mimée par l’abaissement du piston.
- La veino-constriction entraîne une montée du niveau de liquide qui fait augmenter la pression veineuse qui elle –même accroît le débit cardiaque.
- Dans le cas des transfusions, la pression moyenne de remplissage augmente, ce qui fait augmenter le débit cardiaque.
Plus la pression veineuse augmente, plus le volume télé-diastolique augmente et donc, le débit cardiaque augmente.
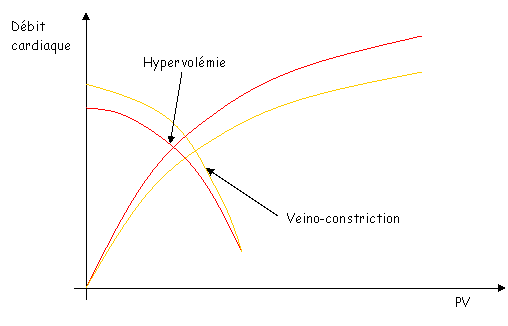
Sur le document 43, en c, le point d’intersections des deux courbes montre un état d’équilibre de la circulation.
Sur ce même document, en d, si la contractilité ventriculaire diminue, on aura un débit faible mais avec une pression veineuse élevée.
Si l’on a contraction veineuse et hypervolémie, cela permet de remonter le débit cardiaque.
Ce phénomène est typique des personnes ayant une insuffisance cardiaque.
Ces courbes permettent de comprendre les fonctions cardiaque et veineuse.
La volémie est essentielle pour le contrôle de la fonction cardiaque. On a des volorécepteurs auriculaires (oreillette droite) qui contrôle la sécrétion d’ADH.
L’oreillette, quand il y a surpression, synthèse de l’ANP qui, sur le rein, fera excrété du sodium et donc de l’eau.
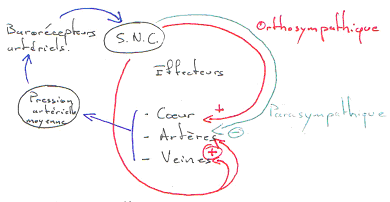
B Régulation de la pression artérielle moyenne.
On trouve une boucle de régulation de cette pression. On a des capteurs de pression (barorécepteurs artériels dans l’aorte ou les carotides). Les informations fournies par ces récepteurs sont traitées par le système nerveux central.
Dc = Fc * Ves.
Ves est fonction de la contractilité ventriculaire (par le système nerveux orthosympathique) mais aussi du retour veineux, lui même fonction de la volémie, des pompes accessoires et de la vasoconstriction.
Les barorécepteurs.
Ces récepteurs sont des fibres nerveuses, sensibles à l’étirement.
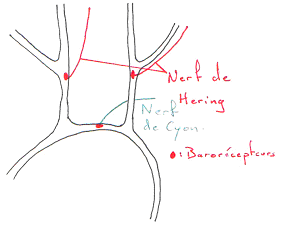
Si la pression est constante, on aura une moins bonne réponse que si l’on a une pression pulsatile. La décharge carotidienne a une phase ascendante où les potentiels d’action augmentent. Elle montre aussi les variations de pression.
Ces nerfs convergent vers le bulbe (noyau trichus solitaire).
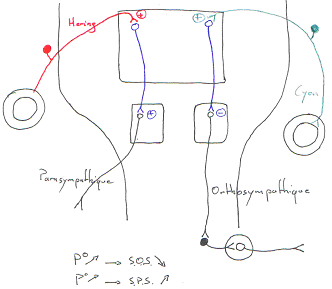
Quand la pression augmente, l’activité du système nerveux orthosympathique diminue alors qu’avec cette même augmentation de pression, l’activité du système nerveux parasympathique s’accroît.
C’est le baroréflexe.
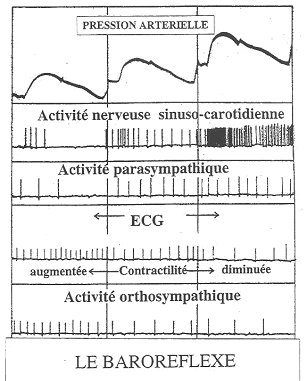
Ce baroréflexe fonctionne tout le temps, d’un battement de cœur à l’autre.
Un autre système dans le rein complète cet effet : c’est le système rénine-angiotensine-aldostérone. C’est une régulation hormonale de la pression artérielle.
Les cellules sécrétant la rénine sont dans l’artériole afférente. Les cellules du tube contourné distal forment la macula densa qui communique avec les cellules à rénine.
Si la pression diminue dans l’artériole afférente, il va y avoir sécrétion de rénine. Cette dernière, dans le sang, hydrolyse l’angiotensine (produite par le foie) en angiotensine 1. Ce produit est transformé en angiotensine 2 par l’action d’enzyme de conversion.
Les effets de l’angiotensine 2 sont une augmentation de la vasoconstriction (qui fait augmenter la pression), une activation du cortex surrénalien qui va produire de l’aldostérone et une sensation de soif. L’aldostérone va entraîner une augmentation de la réabsorption de sodium (et de l’eau qui lui est associée).
Les cellules à rénine mesure la pression par leur propre étirement. Ces cellules sont innervées par le système nerveux orthosympathique et quand elles sont stimulées, elles vont sécréter de la rénine. La diminution de la concentration en sodium du tube contourné distal entraîne, par les cellules de la macula densa, une stimulation des cellules à rénine.
C La posture.
Quand le sujet est couché, il n’y a pas de différence de hauteur entre la tête, le cœur et les pieds La pression artérielle moyenne dans l’aorte est de 100mm Hg. Elle est de 95mm Hg dans les pieds et la tête.
La pression veineuse est de 2mm Hg dans le cœur, de 5mm Hg dans les pieds et la tête.
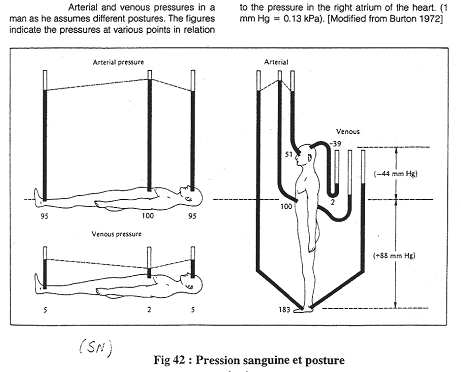
Au levé, au niveau du cœur, rien ne change.
En dessous du cœur, dans les pieds, la pression est de 95mm Hg + la pression hydrostatique (88mm Hg), soit 183mm Hg.
Au dessus du cœur, dans le crâne, on a une pression de 54mm Hg, soit 95mm Hg – 44mm Hg.
Une des conséquences est qu’au niveau des pieds, la pression augmente fortement et brutalement.
Les capillaires.
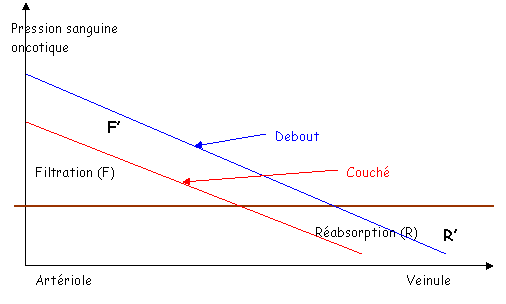
L’augmentation de la pression due au levé va entraîner l’accumulation d’eau, ce qui peut provoquer des oedèmes.
Il existe toutefois des phénomènes qui luttent contre cet effet de la pesanteur :
- La vasoconstriction myogénique. Moins de sang arrive dans les capillaires.
- Il y a constriction veineuse de temps en temps sur le retour, ce qui fait diminuer la pression mais aussi augmenter le retour veineux.
On peut citer le problème capillaire, mais le principal problème est le retour veineux.
Les vaisseaux sanguins forment un réseau continu où le liquide qui descend attire celui qui monte.
D Exercices physiques.
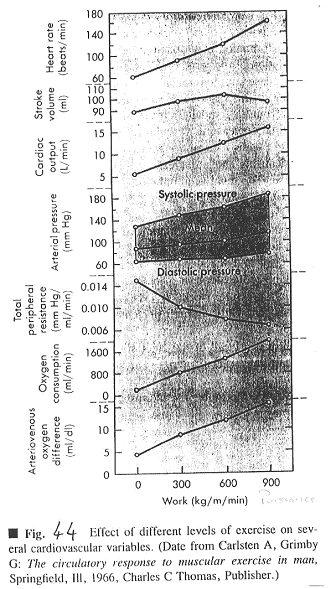
Ce document est un rassemblement de mesures de différents facteurs.
On voit que Fc monte régulièrement. Ves, à puissance élevée donne soit un plateau, soit une petite baisse.
Ves augmente car il y a augmentation du retour veineux, de la ventilation pulmonaire et stimulation du système nerveux orthosympathique.
Le débit cardiaque (Dc) augmente, ce qui est normal, car Dc=Fc*Ves.
La pression artérielle augmente à peine, c’est donc la résistance périphérique qui diminue. Cette diminution de résistance périphérique est due à la vasodilatation des artérioles des muscles. En premier, la vasodilatation est due au métabolisme. Ensuite, elle est due aux fibres musculaires lisses artérielles qui ont des récepteurs b (et donc vasodilatateurs) alors que les autres artères ont des récepteurs a1 (qui donneraient une contraction).
Le débit cardiaque est multiplié par 5 et toute l’augmentation est dirigée vers les muscles (dont le cœur) : on a donc une très importante vasodilatation des vaisseaux musculaires.
La pression diastolique est à peu près constante mais la pression systolique, elle, augmente. Ceci est expliqué par le Ves qui augmente (au début) et par la diminution de la durée de la phase d’éjection ventriculaire.
Bonjour,
Très complet. Juste une remarque les cardiomyocytes sont plurinucléés. Un cardiomyocyte de rat à le plus souvent deux noyaux. Un cardiomyocyte de porc peut en avoir une dizaine.
http://www.google.fr/imgres?imgurl=http%3A%2F%2Fwww.ottawaheart.ca%2Fimages%2FPic-2.jpg&imgrefurl=http%3A%2F%2Fwww.ottawaheart.ca%2Ffrench%2Frecherche_decouvertes%2Flaboratoire-de-signalisation-moleculaire_galerie.htm&h=291&w=290&tbnid=p5OOGy-sV15QeM%3A&zoom=1&docid=2_WXvLuBUYGnSM&ei=h4FaVNv-DejbsAST7gE&tbm=isch&iact=rc&uact=3&dur=973&page=1&start=0&ndsp=44&ved=0CEIQrQMwCg
Bien cordialement,
AG