Biologie du Développement :
TP 3 :
Développement des amphibiens.
Télécharger le document sur le serveur FTP ou sur le serveur web (HTTP).
STRUCTURE DE L’OEUF D’AMPHlBlEN
Fig. 31
Le chapitre traitant de l’ovogenèse a exposé les mécanismes de la formation de cet oeuf hétérolécithe. Cette structure conditionne les modalités de segmentation.
Oeuf vierge
L’œuf vierge d’Amphibien Anoure ou Urodèle est une cellule arrondie de deux millimètres de diamètre. Il possède un axe de symétrie qui passe par le pôle animal sous lequel se trouve le noyau en métaphase de seconde division de méiose, au sommet de l’hémisphère animal, et par le pôle végétatif, à l’opposé, au sommet de l’hémisphère végétatif.
On distingue une couche de cytoplasme cortical superficiel et un cytoplasme interne.
Sous le plasmalemme (membrane plasmique) de l’œuf non fécondé, le cytoplasme cortical ne contient pas de plaquettes vitellines. Il est plus visqueux que le cytoplasme interne avec un cytosquelette constitué d’un réseau de microfilaments d’actine enserrant dans ses mailles des granules corticaux superficiels et des pigments (mélanine) en profondeur. Les granules corticaux sont d’origine golgienne ; ils sont absents chez les Amphibiens Urodèles. Les pigments sont répartis suivant une intensité qui diminue souvent chez certaines espèces, dans l’hémisphère végétatif. Ils sont également absents au voisinage du pôle animal de l’œuf vierge où le noyau est voisin de la membrane cellulaire : c’est la tache de maturation, emplacement où les globules polaires sont expulsés à la suite de la méiose, au cours de la maturation et de la fécondation.
Le cytoplasme interne est hétérogène. C’est le résultat d’une répartition inégale des produits de synthèses élaborés pendant l’ovogenèse. Schématiquement, des ARN stables se répartissent suivant un gradient décroissant du pôle animal au pôle végétatif. A l’inverse, des réserves lipidiques, protéiques et glucidiques formant notamment des plaquettes vitellines suivent un gradient de taille croissante du pôle animal au pôle végétatif et de la périphérie de l’œuf vers le centre, de sorte que le hyaloplasme est peu abondant dans l’hémisphère végétatif. L’analyse globale montre que l’œuf d’Amphibien contient 52,5% d’eau, 34,5% de protéines, 7,5% de graisses, 3 %de glucides, 2%de substances diverses.
1. Cet embranchement contient aussi des espèces vivipares et des espèces à oeufs télolécithes.
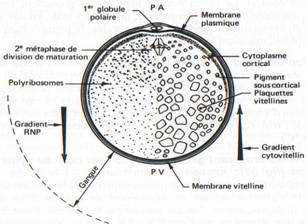
Fig. 31. — Schéma d’un oeuf vierge de grenouille mettant en évidence le pigment cortical présent surtout dans l’hémisphère animal, les gradients de concentration croissante des ribonucléoprotéines, en allant du PV vers PA, et du vitellus, suivant un gradient inverse PA vers PV.
Modifications des structures cytoplasmiques à la fécondation.
La pénétration du spermatozoïde dans l’hémisphère animal déclenche des remaniements cytoplasmiques dont la conséquence sera de déterminer le plan de symétrie de l’embryon dans les deux heures qui suivent la fécondation.
Le second globule polaire est émis après la pénétration du spermatozoïde, la tache de maturation disparaît par contraction du cytosquelette du feuillet pigmentaire cortical. Le noyau femelle haploïde ou pronucléus femelle se porte à la rencontre du noyau spermatique, pronucléus mâle, en une aire plus profonde du cytoplasme, le spermatozoïde entraîne du pigment dans le cytoplasme profond, marquant la traînée spermatique.
Rétraction de l’œuf dans ses enveloppes: rotation d’orientation. —Après la réaction corticale, la plasmalemme est libérée du contact avec la membrane vitelline devenue la membrane de fécondation. L’œuf s’équilibre selon les lois de la pesanteur, le pôle végétatif plus lourd s’oriente vers le bas. Cette rotation d’équilibration s’achève en 30 minutes et intéresse la totalité de la masse de l’œuf. (La chronologie qui est donnée correspond au développement à 180C).
Formation du croissant gris, acquisition du plan de symétrie de l’embryon (fig. 32): rotation de symétrisation. — 1 heure dix après la fécondation, un déplacement de cytoplasme superficiel comprenant la couche pigmentaire s’effectue suivant un mouvement de bascule d’une ampleur d’environ 30 degrés, autour d’un axe passant par le centre de l’œuf, et orthogonal à un plan déterminé par l’axe P.A.-PV. et la traînée spermatique. Le sens du déplacement est tel que le pigment descend vers le PV. du côté correspondant au point de pénétration du spermatozoïde et remonte vers le P.A. du côté opposé. La zone de remontée a une forme de croissant de teinte grisâtre due à du pigment resté sur place, le croissant gris. C’est dans le plan défini par P.A.-PV. et traînée spermatique que la remontée du pigment est à son maximum. Ce plan constitue le plan de symétrie de l’embryon et le croissant gris sa région dorsale. Le mouvement superficiel du cortex est appelé rotation de symétrisation.
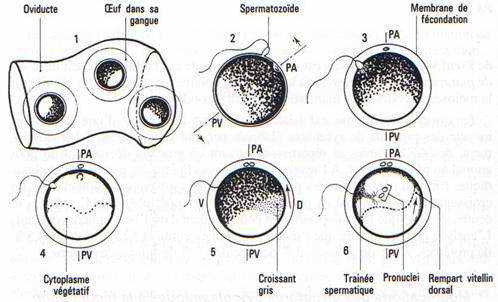
Fig. 32. Rotations d’orientation et de symétrisation dans l’œuf d‘Amphibien. 1 : Œufs dans l’oviducte orientés de façon quelconque. 2 et 3 : Pénétration du spermatozoïde, décollement de la membrane de fécondation, rotation d’orientation. 4-6 : Rétraction superficielle du pigment vers le point de pénétration du spermatozoïde, et formation du croissant gris dorsal. Remaniement profond du cytoplasme végétatif et formation du rempart vitellin dorsal. OEuf vu en coupe sagittale avant (4) et après (6) la rotation de symétrisation.
Chez le xénope (fig. 32), ce mouvement est dirigé par le spermaster qui se développe, lors de la pénétration du spermatozoïde. dans le cytoplasme de l’hémisphère animal autour du centriole spermatique et qui suit la migration du pronucléus mâle. Après la fusion des pronucléi mâle et femelle au centre de l’hémisphère animal, le cortex dorsal se contracte en direction du point d’entrée du spermatozoïde, entraînant un retrait dans la partie dorsale. Le sens de ce mouvement du cortex dorsal est sans doute induit par les interactions entre les microfilaments du cortex dorsal et les microtubules du spermaster qui sont largement développés. Des mouvements cytoplasmiques plus profonds créent aussi dans le vitellus une dissymétrie avec remontée d’un mur vitellin dorsal (Ubbels et al. 1983).
Chez les Urodèles qui sont polyspermiques, on ne connaît pas de relation entre croissant gris et pénétration du spermatozoïde. Il est possible que, dans ce groupe, le plan de symétrisation soit prédéterminé.
Segmentation.
Fig. 33
C’est une segmentation totale et inégale.
Le développement se déroule à l’intérieur de la membrane de fécondation, jusqu’à l’éclosion.
La durée de la segmentation varie avec les espèces. Chez l’axolotl, un Urodèle, le premier sillon de segmentation qui sépare les deux premiers blastomères apparaît 2h30 après la fécondation et coïncide dans 50 % des cas avec le plan de symétrie bilatérale de l’embryon. Après une seconde division suivant un plan méridien perpendiculaire au premier et une troisième sus-équatoriale, les blastomères commencent à s’écarter sur leur face interne pour délimiter un blastocèle qui occupera surtout l’intérieur de l’hémisphère animal. Les 2 plans de division suivants sont méridiens et forment un angle de 45° avec les deux premiers. Les divisions sont d’abord synchrones pendant onze cycles, chaque cycle, dépourvu de phase G1, dure 70 minutes. Ce rythme se ralentit et les divisions deviennent asynchrones, avec allongement de G2 et apparition de G1, après le 11ème cycle qui correspond à la transition blastuléenne ou mi-blastula. Le ralentissement est plus marqué dans l’hémisphère végétatif. Au bout de 30 heures à 18 0C, l’embryon compte environ 10000 cellules et la gastrulation commence.
La chronologie est différente chez le xénope, avec des cycles de 35 minutes et une mi-blastula atteinte à la 9e heure de segmentation. Chez d’autres espèces aux oeufs volumineux, certaines rainettes, elle est par contre beaucoup plus lente.
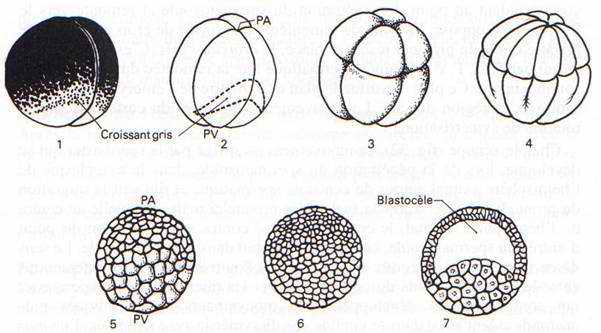
Fig. 33. —Segmentation de l’œuf d’Amphibien représenté dépourvu de sa gangue. 1 à 4 : Stades 2 à 16 ; 5 : Morula ; 6-7 Blastula en vue externe et en coupe.
Gastrulation.
Fig. 34
Dans cet œuf hétérolécithe, la totalité des cellules contenant des inclusions vitellines est concernée par les mouvements morphogénétiques. La gastrulation dure 24 heures chez le pleurodèle ou l’axolotl, mais seulement 7 heures chez le xénope.
Une zone d’invagination cellulaire ou blastopore se situe sous l’emplacement du croissant gris dont les limites se sont estompées pendant la segmentation. C’est d’abord un sillon incurvé, horizontal, la lèvre dorsale du blastopore qui évolue tandis que les tissus mésodermique et endodermique pénètrent dans la cavité de segmentation et forment une seconde cavité qui s’y emboîte, l’archentéron. La lèvre blastoporale s’incurve, avec son prolongement par les lèvres latérales, puis se referme en un cercle avec l’apparition de la lèvre ventrale du blastopore, entourant le bouchon vitellin constitué par les cellules endodermiques encore visibles à l’extérieur et dont le diamètre se réduit progressivement. Le blastopore prend enfin la forme d’une fente blastoporale verticale lorsque l’invagination est achevée. Cette fente correspond à l’anus chez les Urodèles. Chez les Anoures, elle s’oblitère, l’anus résulte d’une réouverture secondaire.
La formation et l’évolution du blastopore sont le résultat d’un mouvement combiné d’élongation et de recouvrement des tissus de l’hémisphère animal (épibolie) et de la disparition passive des cellules chargées en vitellus de l’hémisphère végétatif (embolie). Les mouvements de l’hémisphère végétatif provoquent une modification du centre de gravité, et un basculement de l’embryon sur la face ventrale. L’axe animal végétatif devient presque horizontal (fig. 34).
Principe d’une analyse de la gastrulation par la technique des marques colorées (Vogt 1925)
Un marquage à l’aide de colorants vitaux des différentes parties de la surface de la blastula fut la première technique qui ait permis de suivre les mouvements cellulaires à la gastrulation et de reconstituer a posteriori une carte du devenir présomptif des différentes parties de la blastula avant la gastrulation: la carte des territoires présomptifs. Il suffisait d’utiliser de minuscules fragments d’agar agar imprégnés de rouge neutre ou de sulfate bleu de Nil qui étaient appliqués à la surface de la blastula immobilisée dans une logette de paraffine et convenablement orientée. On suivait ensuite le cheminement des marques colorées ainsi obtenues (fig. 34), ce qui permettait de préciser la chronologie, le sens et l’importance des mouvements des tissus pendant la gastrulation. D’autre part, on identifiait les différentes ébauches d’organes où se retrouvent les cellules colorées. Pour repérer sur la jeune blastula les emplacements normalement destinés à former un feuillet ou un organe donné, il suffisait d’y reporter après coup l’aire correspondant à ces organes et d’établir ainsi une carte des territoires présomptifs.
La carte des territoires ainsi dressée par Vogt reste très commode pour décrire les mouvements morphogénétiques. Cependant, on ne peut plus considérer qu’elle indique très exactement la destinée des cellules d’un territoire. En effet, ce marquage n’est pas assez précis; un certain degré de mélange cellulaire se produit à la frontière des territoires, dès la segmentation, puis à la gastrulation, ce que les marques colorées ne permettent pas de repérer. Par ailleurs, les plans de segmentation ne Sont jamais exactement reproductibles.
Des travaux réalisés sur diverses espèces, telles que le pleurodèle (Delarue et coll., 1992), le xénope (Dale et Slack, 1987), utilisent des colorants vitaux marqués à la fluorescéine ou à la rhodamine, qui sont injectés à des stades précoces du développement, par exemple dans chacun des blastomères d’une morula au stade 32 cellules du xénope, choisie pour la régularité de sa segmentation. Ils retrouvent à la neurula la position de chacune des cellules filles issues de chaque blastomère, ce qui leur permet de rétablir leur filiation jusqu’à la morula. Il existe certes une relation avec la cartographie classique, mais on constate aussi qu’une fraction des cellules dérivées des blastomères bien identifiés s’est trouvée intégrée, au stade neurula, dans des ébauches d’organes que l’analyse classique ne prévoyait pas. Les frontières entre les différents territoires sont donc beaucoup moins précises qu’il n’apparaît avec la méthode de Vogt.
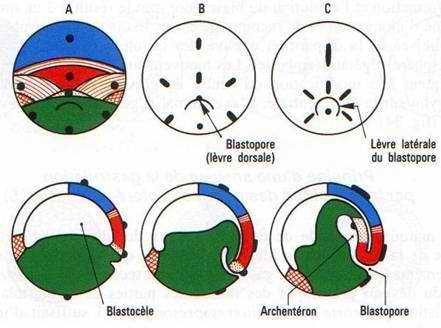
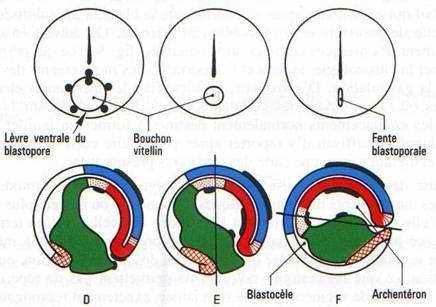
Fig. 34. — Gastrulation d’embryon d’Amphibien. Vues externes dorsales la lèvre blastoporale dorsale (A) se prolonge par des lèvres latérales (B, C) qui se rejoignent par une lèvre ventrale (D) le tout circonscrit un bouchon vitellin qui se réduit (D, E), fait place à une fente blastoporale (F) quand l’endoderme a disparu à l’intérieur. Les vues en coupe sagittale montrent la formation de l’archentéron, la réduction du blastocèle, l’élongation des feuillets ectoblastiques et mésoblastiques. A la fin de la gastrulation, l’embryon bascule sur la face ventrale (F). Des marques colorées, représentées ici en noir, sont déposées à la surface de la blastula. On suit leurs déformations et leurs migrations jusqu’à la fin de la gastrulation. Les territoires sont représentés suivant des conventions précisées (fig. 35).
On peut conclure qu’il n’existe pas pendant la gastrulation de ségrégation rigoureuse entre les cellules issues des territoires cytoplasmiques de l’œuf.
On ne peut qu’apprécier la probabilité pour que telle cellule issue d’une aire cytoplasmique donnée ait telle descendance.
Il faut noter que la carte classique des territoires qui est présentée ici est celle d’un Urodèle. Elle ne convient pas exactement au xénope chez qui les aires présomptives mésodermiques ne sont pas visibles en surface.
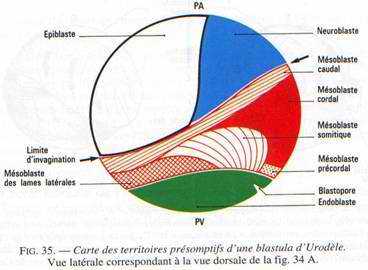
Carte des territoires présomptifs
Fig. 35
Elle ne préjuge pas de l’état de détermination des territoires mais n’indique que leur destinée probable. On n’envisagera ici que les grandes subdivisions, bien que des localisations plus précises (organes des sens par exemple) soient connues.
1. L‘ectoblaste correspond à peu près à l’hémisphère animal. Il se subdivise en épiblaste ventral qui donnera l’épiderme et ses dérivés (placodes sensorielles notamment) et en neuroblaste dorsal, à l’origine du système nerveux.
2. Le mésoblaste forme une ceinture équatoriale et sous-équatoriale, plus large dorsalement. On identifie dorsalement les territoires de la corde et du mésoderme précordal à l’emplacement du croissant gris; latéralement, les territoires des somites et du mésoderme latéral, puis le mésoderme caudal.
3. L’endoblaste appartient à l’hémisphère végétatif. Il est à l’origine de l’épithélium du tube digestif et de ses dérivés. Il s’y forme les cellules germinales primordiales chez les Anoures.
Interprétation des mouvements morphogénétiques à la gastrulation
Fig. 36
Les tissus situés sous la limite de l’ectoblaste vont passer à l’intérieur. Les mouvements sont complexes. On peut les décomposer comme suit :
- a) Involution ou enroulement des tissus mésoblastiques situés au-dessus de la lèvre dorsale du blastopore, qui forment un feuillet mince et souple.
- b) Convergence des tissus mésoblastiques axiaux et des somites vers les lèvres blastoporales dorsales et latérales où ils involuent.
- c) Élongation des tissus de l’hémisphère animal, ectoblaste et mésoblaste, l’allongement des tissus du mésoblaste se poursuivant encore à l’intérieur, après son involution. L’élongation de l’ectoblaste lui permet de recouvrir activement par épibolie, la totalité de l’embryon. Le front de progression de ce feuillet autour de la masse de l’endoblaste devient visible à la fin de la gastrulation par la matérialisation de lèvres latérales et ventrales du blastopore.
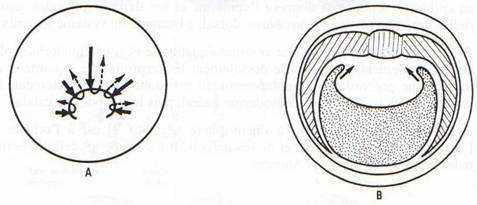
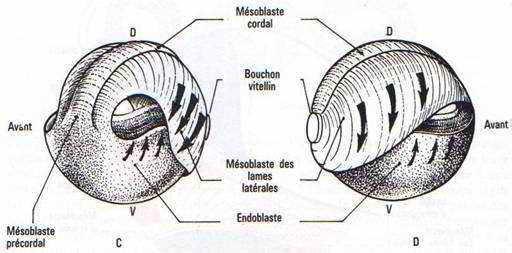
Fig. 36. —Mouvements morphogénétiques à la gastrulation.– A : Vue dorso-végétative d’une gastrula avec indication des mouvements de convergence, élongation, enroulement autour des lèvres blastoporales, et divergence en profondeur. B : Coupe de gastrula âgée lors de l’extension du mésoblaste et de l’endoblaste. C et D : Mouvements d’extension du mésoblaste, de l’endoblaste (flèches), l’ectoblaste étant supposé enlevé. C vue de l’avant. D : vue de l’arrière. D : Embolie de la masse de l’endoblaste recouverte par les tissus qui progressent au niveau des lèvres blastoporales qui entourent sa partie visible ou bouchon vitellin.
Le résultat de ces mouvements (Fig. 34 F) est, au stade du bouchon vitellin, la formation d’un germe à deux feuillets; l’un, externe ou ectoderme, l’autre interne, composite avec une voûte dorsale mince de mésoderme et un plancher massif d’endoderme. Le feuillet interne limite une cavité nouvelle, l’archentéron, qui s’ouvre au niveau d’un blastopore qui peut se fermer pour s’ouvrir plus tard et former l’anus en une aire dépourvue de mésoderme. La cavité de segmentation est à peu près totalement oblitérée.
Simultanément, à la limite entre endoderme et mésoderme entourant l’archentéron, une discontinuité se crée. Il y a divergence du matériel mésodermique des lames latérales qui s’étale à droite et à gauche puis vers le bas entre ectoderme et endoderme, tandis que les parois latérales de l’endoderme convergent et tendent à se rejoindre dorsalement pour délimiter l’archentéron. Le mouvement s’achève dans la neurula. Trois feuillets emboîtés se mettent ainsi en place, l’ectoderme, qui s’épaissit sur la face dorsale, le mésoderme et l’endoderme. Dans le mésoderme, la couche axiale va s’isoler progressivement, le mésoderme précordal se dissocie sous l’ectoderme et la future région céphalique (Fig. 37).
Neurulation.
Fig. 37
Cette étape du développement embryonnaire s’achève en 24 heures à 18 0C chez les Urodèles.
• 1. — Extérieurement, on note un allongement dans le sens antéro-postérieur et un aplatissement de l’embryon dans la région dorsale, qui délimite la plaque neurale en forme de raquette. Celle-ci se creuse en gouttière, se referme d’abord au niveau médian puis s’isole, formant le tube nerveux. Des épaississements latéro-dorsaux répétés au niveau du tronc sont la manifestation de la différenciation des somites. Des épaississements antérieurs et latéraux dans la région du cerveau marquent les ébauches des placodes sensorielles (cristallin, oreille interne) et des bourgeons branchiaux.
• 2. — Les mouvements internes sont la continuation des mouvements gastruléens.
1. La zone dorsale de l’ectoderme, en contact étroit avec le mésoderme se différencie en neuroblaste sous l’influence inductrice de ce dernier (3e partie, chap. 4). Les bords latéraux de l’aire aplatie de la plaque neurale forment les bourrelets médullaires. Leur partie la plus externe forme les crêtes neurales. La fusion des bourrelets dans le plan de symétrie de l’embryon isole un tube nerveux du restant de l’ectoderme. Celui-ci n’est plus alors constitué que par de l’épiblaste qui recouvre la totalité de l’embryon et d’où s’isoleront plus tard des placodes sensorielles. Le tube nerveux est élargi vers l’avant en une vésicule céphalique, futur encéphale; il est flanqué latéralement par les crêtes neurales.
2. Dans le mésoderme, les somites s’individualisent. Leur nombre varie suivant l’espèce. Ce sont des masses de mésoderme paires, situées de part et d’autre de la corde qui est axiale. Ils forment une structure répétitive qui se différencie en arrière du niveau de la vésicule céphalique dans le sens antéropostérieur. La corde s’isole en un cylindre de cellules turgescentes. Le mésoderme précordal s’étale sous la vésicule céphalique. Les lames latérales se creusent d’une cavité ou cœlome qui est à l’origine de la cavité générale. Le feuillet externe est la somatopleure, le feuillet interne la splanchnopleure. Entre les lames latérales et les somites, des zones d’étranglement constituent les pièces intermédiaires qui s’isoleront des somites mais restent en communication avec la cavité cœlomique. Comme les somites, elles se métamérisent et forment les gononéphrotomes à l’origine de l’appareil uro-génital.
3. L’endoderme achève son mouvement de fermeture dorsale. Il se trouve au contact direct de l’ectoderme aux emplacements de la future bouche et du futur anus.
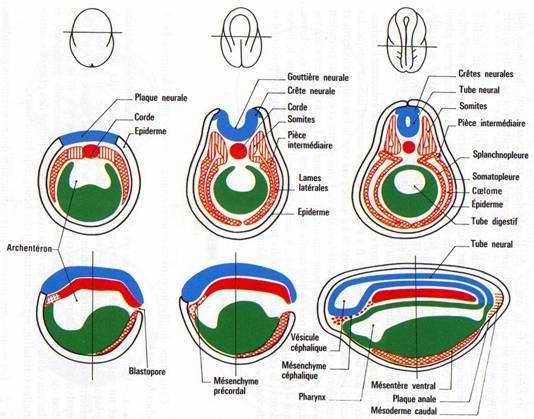
Fig. 37. Neurulation d’embryon d’Amphibien. 3 stades différents : Plaque neurale, gouttière neurale et tube neural. Haut : vues externes dorsales. Milieu : coupes transversales. Bas : coupes longitudinales.
Évolution des feuillets après la neurulation.
Fig. 38
Le devenir de chacun de ces territoires est illustré par des schémas de bourgeon caudal en coupes transversale et longitudinale.
L’Ectoderme
1. Neuroblaste
— Vésicule céphalique: formée d’abord de trois vésicules : le prosencéphale, le mésencéphale, le rhombencéphale. La première se divise en télencéphale (hémisphères cérébraux) et diencéphale (avec les vésicules optiques); la deuxième donne les lobes optiques et pédoncules cérébraux, la dernière forme le métencéphale (cervelet) suivi du myélencéphale (bulbe rachidien).
— Tube nerveux: moelle épinière.
— Crêtes neurales: ganglions nerveux crâniens et rachidiens, ganglions des systèmes sympathique et parasympathique, certains muscles lisses et striés de la tête et du cou, une partie du squelette cartilagineux de la tête, certains éléments des tissus conjonctifs de la tête, les cellules pigmentaires, les glandes médullo-surrénales.
2. Epiblaste
— Épiderme et phanères (poils, plumes, cornes, etc.).
— Placodes sensorielles (vésicules olfactives, cristallins, vésicules auditives).
— Placodes des lobes antérieur et intermédiaire de l’hypophyse, de certains ganglions crâniens; elles participent aussi avec les crêtes neurales céphaliques à la formation du squelette des arcs branchiaux chez la larve.
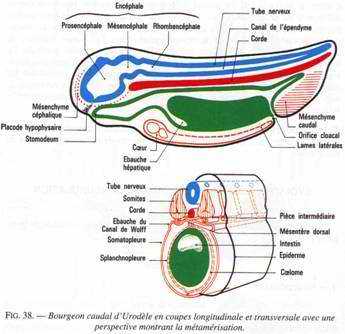
Le Mésoderme
1. Mésoderme cordal et précordal :
La corde régresse en général, subsiste chez quelques Poissons. Le mésoderme précordal forme le mésenchyme céphalique d’où dérive une partie du squelette et du mésoderme de la tête.
2. Somites :
Les sclérotomes : ébauches du squelette axial; les myotomes : muscles striés dorsaux et ventraux; les dermatomes derme et mésenchyme.
3. Pièces intermédiaires
Elles restent provisoirement en communication avec le cœlome des lames latérales situées du même côté ; elles forment la médulla des gonades, les uretères.
4. Lames latérales
Elles sont constituées par 2 feuillets se rejoignant ventralement puis dorsalement et formant les mésentères dorsal et ventral :
- La splanchnopleure (ou feuillet interne) à l’origine de muscles lisses, myocarde, endocarde, endothélium des vaisseaux sanguins, les cellules sanguines.
- La somatopleure (feuillet externe) à l’origine de la musculature viscérale de la tête, le péricarde, le squelette et la musculature des membres, le cortex des gonades.
L’Endoderme
Épithéliums du tube digestif et des glandes annexes (glandes salivaires, foie et pancréas), de la cavité pharyngienne et de ses dérivés (thyroïde, para-thyroïde, thymus), l’épithélium pulmonaire, la vessie.
La métamérisation chez les vertébrés.
La segmentation du mésoderme para-axial en somites est une manifestation de l’organisation métamérisée des Vertébrés.
Un métamère est une unité d’organisation du corps qui, chez certains Invertébrés, se répète presque à l’identique, délimitant des segments le long de l’axe antéro-postérieur (ex: segments de Vers Annélides). Au cours de l’évolution, une spécialisation régionale de plus en plus poussée est apparue, comme chez les Insectes, aboutissant même à ce que la structure avec segments visibles ne reste perceptible que chez l’embryon, c’est le cas des Vertébrés. Il n’en demeure pas moins que de nombreux caractères de la métamérie subsistent chez l’adulte:
- Les vertèbres, par exemple, sont des structures métamérisées, formées par l’union d’éléments provenant de la moitié antérieure d’un somite et de la moitié postérieure de celui qui le précède.
- La division en somites du mésoderme dorso-latéral influence la disposition d’autres organes, notamment la distribution des nerfs moteurs, des ganglions spinaux et sympathiques dont la répartition est imposée par le découpage du mésoderme dorso-latéral en sclérotomes, une paire de ganglions se situant entre deux sclérotomes successifs.
- Le mésoderme dorsal n’est pas seul à être métamérisé; le rhombencéphale de la jeune neurula est segmenté en rhombomères et cette organisation conditionne celle, ultérieure, des nerfs crâniens, du mésoderme pharyngien (arcs viscéraux), ainsi que la destinée des cellules des crêtes neurales, qui semble dépendre de leur rhombomère d’origine.
Nous verrons que chaque métamère se différencie en fonction du niveau où il se trouve le long de l’axe antéro-postérieur du corps, et que cette différenciation est régulée par des familles de gènes régulateurs, dont les mieux connus actuellement sont les gènes sélecteurs homéotiques.
merci bien c’est un très bon documentaire
Bonjour,
Très bon cours. Je me pose quand même une question. Les CCN apparaissent au moment de la fermeture du tube neural. Il est dit que les CCN du r2 et 3 forme le nerf trijumeau et les CCN (des cretes) peuvent former les nerfs sensoriels. Ma question est: quelle est la relation entre les cellules du r2 (par exemple) et les CCN issues des crêtes? je me pose cette question car les CCN n’ont pas de territoire d’expression commun avec les rhombomères si je ne me trompe?
Merci d’avance si vous pouviez m’éclairer un peu.
bien cordialement,
corinne faucheux (MCU bordeaux, cofaucheux@yahoo.fr)
parfait
très bien expliqué
un grand merci
Merci beaucoup les cours sont trés bien expliqué